蛋白质翻译后修饰(PTM)包括磷酸化、甲基化,乙酰化等。蛋白质表达受基因组和表观遗传学的调控,并且在表达以后还需要经过不同程度的修饰才能发挥所需要的功能,PTM研究至关重要。
文章解读
下面让我们看看2018年蛋白质修饰领域有哪些重要研究。
【1】PNAS:泛素样蛋白ubiquilin 2(UBQLN2)调节ALS/FTD连接的FUS-RNA复合物动力学和应激颗粒形成
发表于PNAS上的一篇文章报道,研究人员在寻找UBQLN2相互作用蛋白时,发现了应激颗粒(SG)成分的富集,包括融合在肉瘤(FUS)中的ALS / FTD连接的异质核糖核蛋白。
通过使用优化的SG检测方法,研究人员观察了UBQLN2及其交互作用。UBQLN2中的低复杂性,类似Sti1的重复区域足以使其定位于SG。在功能上,UBQLN2负调节SG形成。UBQLN2增加了FUS-RNA相互作用的动力学,并在单分子水平上促进了FUS-RNA复合物的流动性。该研究结果揭示了UBQLN2通过直接调节蛋白质-RNA复合物的流动性和SG形成的动力学,为研究相关疾病的发生提供线索。
【2】Science :LZTR1是RAS泛素化和信号传导的调节剂
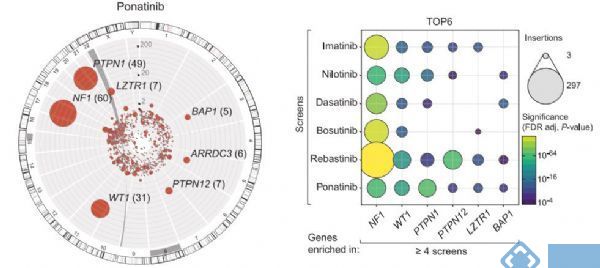
发表于science的一项研究报道,在旨在了解慢性粒细胞白血病细胞的耐药机制的遗传筛选中,编码LZTR1(cullin 3受体蛋白编码亮氨酸拉链样转录调节因子1)导致丝裂原激活的蛋白激酶途径活性增强和对酪氨酸激酶抑制剂的敏感性降低。该研究结果为LZTR1参与多种遗传性和获得性人类疾病提供了分子基础。
研究显示,除果蝇LZTR1直向同源物CG3711会引起RAS依赖性功能表型增加。LZTR1的失活则导致泛素化减少和内源性KRAS的质膜定位增强。LZTR1可作为RAS泛素化和MAPK途径激活的保守调节剂
【3】EMBO J:分泌途径激酶Fam20C可通过磷酸化内质网巯基氧化酶Ero1a来调控内质网的氧化还原稳态
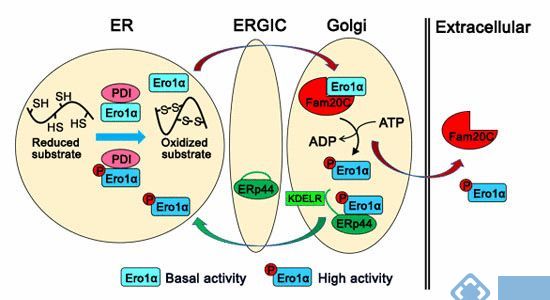
蛋白激酶Fam20C是第一个被发现的分泌途径中的蛋白激酶,Fam20C能够催化100多种分泌到胞外的蛋白的磷酸化,其功能缺陷与骨发育不良疾病雷恩综合症密切相关。然而,Fam20C对内质网等分泌途径细胞器功能的研究几乎是空白。
发表于EMBO J的一篇文章报道,研究人员首先通过相互作用蛋白组学方法发现Fam20C和349个定位于内质网和高尔基体的蛋白质有相互作用,蛋白质折叠通路的许多关键酶被高度富集。之后进行进一步研究,发现分泌途径激酶Fam20C可通过磷酸化内质网巯基氧化酶Ero1a来调控内质网的氧化还原稳态。
该研究首次建立了蛋白质的磷酸化修饰与氧化折叠之间的联系;为内质网等分泌途径细胞器的环境和功能的调控提供了新的机制;揭示了蛋白质磷酸化修饰新的生物学功能。
【4】Cell Rep: CSAP是TTLL介导的微管谷氨酰胺化的调节剂
微管蛋白谷氨酰化是可逆的翻译后修饰,其积聚在稳定的微管(MT)上。异常高水平的这种修饰导致许多疾病,例如雄性不育,视网膜变性和神经变性,但对谷氨酰酶活性调节的分子机制知之甚少。发表于Cell Rep的一篇文章报道,CSAP是TTLL介导的微管谷氨酰胺化的调节剂。
研究人员发现CSAP与TTLL5形成复合物,并且证明了这两种蛋白质互相调节它们的相互丰度。研究还显示CSAP增加TTLL5介导的谷氨酰化并识别TTLL5相互作用结构域,失去此域会导致CSAP激活功能完全丧失,但是不会影响其MT结合。CSAP与TTLL5的结合促进TTLL5向MT的重定位。最后,作者显示CSAP结合并激活所有剩余的自主活性TTLL谷氨酰酶。
【5】Cell Rep:SIRT1通过暂时调节中心体Plk2水平来控制中心体复制
中心体是细胞周期进展和基因组稳定性的关键调节因子,已有研究显示SIRT1(Sirtuin 1)调节许多细胞过程,包括细胞周期进展、DNA损伤反应和代谢,但两者间的联系仍然知之甚少。发表于Cell Rep一篇文章报道,乙酰化保护Plk2免于泛素化,并且SIRT1介导的去乙酰化促进Plk2的泛素依赖性降解。该研究揭示了SIRT1在中心体复制中的关键作用。
研究显示,SIRT1通过暂时调节中心体Plk2水平来控制中心体复制。
AURKA磷酸化SIRT1并促进有丝分裂中的SIRT1-Plk2相互作用。在G1早中期,磷酸化的SIRT1脱乙酰化并促进Plk2降解。在G1晚期,SIRT1被减磷酸化并且其对Plk2的亲和力降低,导致中心体Plk2的快速积累,引发中心体复制。
结论
蛋白质修饰对生理活动的精细调控具有重大意义,蛋白质修饰使蛋白质的结构更为复杂多样、功能更为明确精细,此外治疗用蛋白质药效的优化也可以通过多种方式的化学修饰来实现,因此蛋白质修饰的研究未来的路还长,我们应回首过去,展望未来,路漫漫其修远兮,还须上下求索。
参考文献
[1] Alexander EJ, et al. Ubiquilin 2 modulates ALS/FTD-linked FUS-RNA complex dynamics and stress granule formation[J]. Proc Natl Acad Sci U S A, 2018.
[2] Bigenzahn JW, et al. LZTR1 is a regulator of RAS ubiquitination and signaling [J]. Science, 2018.
[3] Zhang J, et al. Secretory kinase Fam20C tunes endoplasmic reticulum redox state via phosphorylation of Ero1α [J]. EMBO J, 2018.
[4] Bompard G et al. CSAP Acts as a Regulator of TTLL-Mediated Microtubule Glutamylation [J]. Cell Rep, 2018.
[5] Ling H, et al. Histone Deacetylase SIRT1 Targets Plk2 to Regulate Centriole Duplication [J]. Cell Rep, 2018.
全国热线:400-168-1806
