题目:Distinct Proteomic, Transcriptomic, and Epigenetic Stress Responses in Dorsal and Ventral Hippocampus
期刊:Biological Psychiatry
影响因子:11.982
研究背景
生活中的压力会导致焦虑、创伤后应激障碍和人类认知障碍。参与急性应激反应的一个关键组织是海马体。急性压力通过改变海马体不同区域功能引发不同的应答反应。海马体的内在组织其长背腹侧轴高度保守,背侧(前部)海马(dHC)参与介导空间导航和记忆形成,而腹侧(后部)海马体(vHC)则参与情绪调节。作者为了研究海马体不同区域压力应答的分子效应,在已有的转录组研究基础之上,结合正在迅速发展蛋白质组学方法,希望揭示生物学和临床相关的生物标志物。
研究内容及结果
1. dHC和vHC的转录组分析
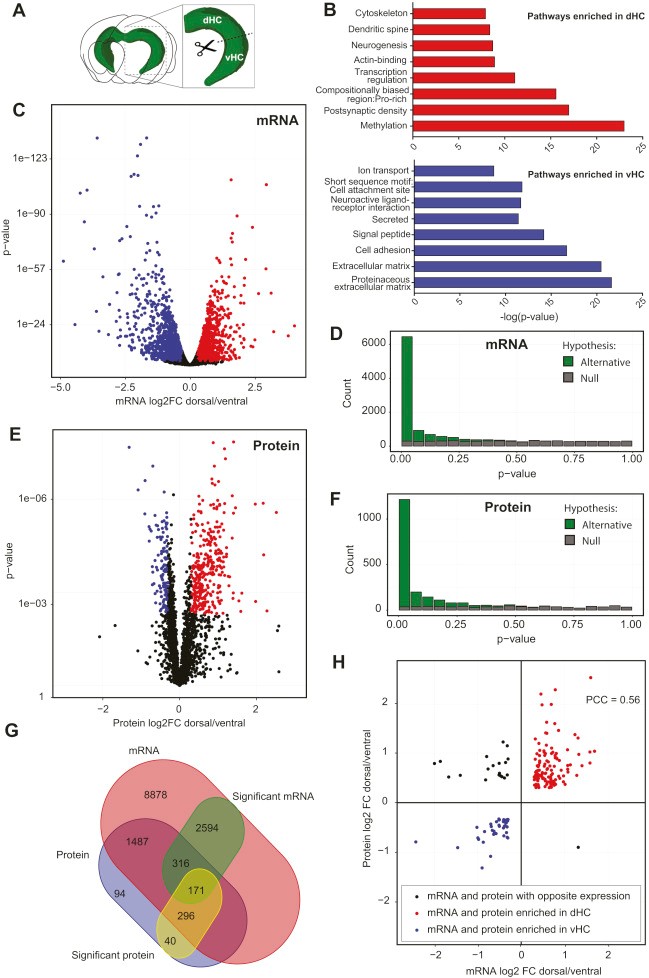
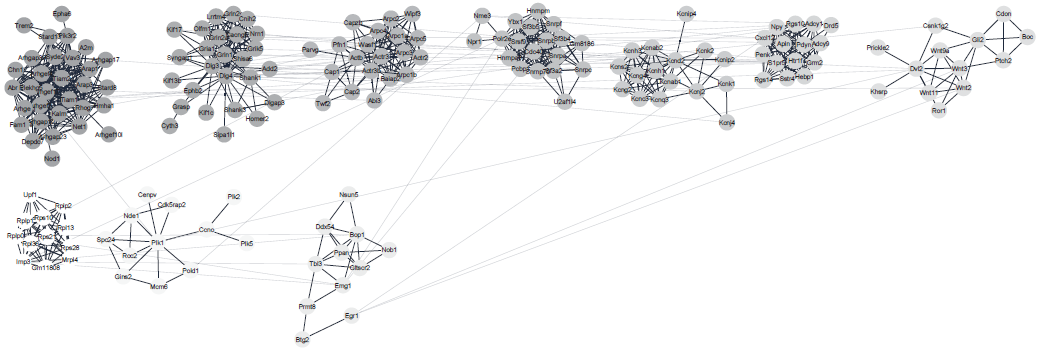
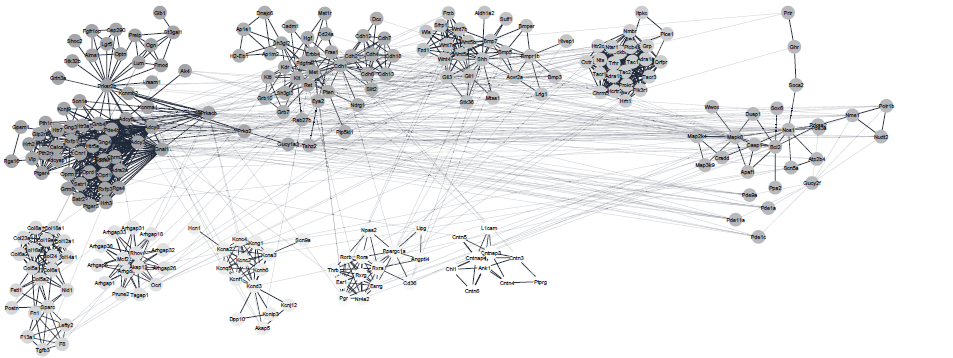
作者选择C57BL/6J 雄性小鼠的海马组织不同区域:背侧区域(dHC)、腹侧区域(vHC)(n=5)进行转录组测序,有超过20%的检测基因(13902个基因中的3081个)在dHC和vHC之间存在差异表达(p <0.005,log2FC >±0.3)(图1C)。随后进行Pathway富集分析,得到几个显著富集通路(图1B)。基于转录组数据,作者对前期研究人员的转录组结果进行验证,最后确定了490个具有强差异表达的基因(FC > 2,p <0.005)。为了深入研究海马体不同区域基因之间的功能相互作用,作者基于已知和预测的蛋白质相互作用网络创建了基因相互作用网络,发现dHC和vHC形成不同的基因功能簇(图2,图3),dHC主要富集参与谷氨酸能突触传递、长时增强效应、内吞作用以及细胞骨架的调控通路,vHC主要富集神经配体-受体激活、含血清素的神经突触和氨基丁酸能突触的通路。
图1 dHC和vHC之间的转录组学和蛋白质组学分析
图2 dHC富集基因网络互作分析
图3 vHC富集基因网络互作分析
2. dHC和vHC的蛋白质组学分析
作者使用SWATH-MS进行蛋白质组定量分析,在本次实验中,质谱定量到2414种蛋白质,Pearson相关性分析表明重复样本之间表现出极好的相关性。与转录组结果类似,作者发现超过20%的蛋白质(2414个蛋白中的513个)在dHC和vHC之间存在差异表达(p <0.005,log2FC >±0.3)(图1E)。
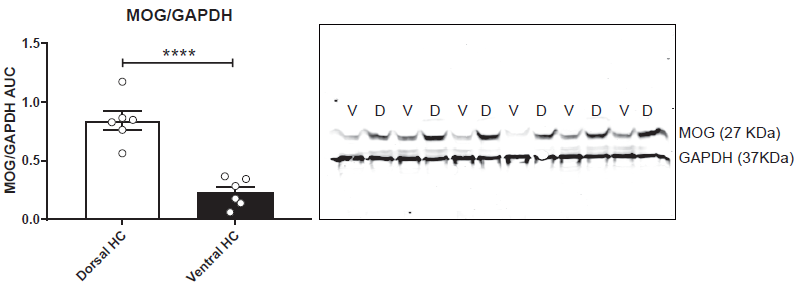
接着将转录组数据和蛋白质组数据联合分析发现,有171个基因在mRNA和蛋白质表达水平均发生了显著变化(图1G),其中有151个基因的mRNA和蛋白质表达呈正相关(r =0.56, n = 171,p <0.0001)(图1H),有37个基因在vHC中富集,114个在dHC富集。通路分析显示dHC中富集的mRNA /蛋白质对主要参与钙信号通路以及谷氨酸能突触传递,vHC中富集的mRNA /蛋白质对主要参与代谢调控。在高富集的mRNA/蛋白质对中,作者发现了Wfs1和Epha7这个两个基因,它们已被证实富含于海马CA1神经元中,这说明蛋白质组学分析能够解决异质性脑切除中亚区域特异性表达差异。此外,作者选择在dHC中高富集的MOG(myelin oligodendrocyte glycoprotein)进行WB验证实验,实验结果和组学结果一致(图4)。
图4 WB验证实验结果
3. 不同压力诱导下转录组表达差异
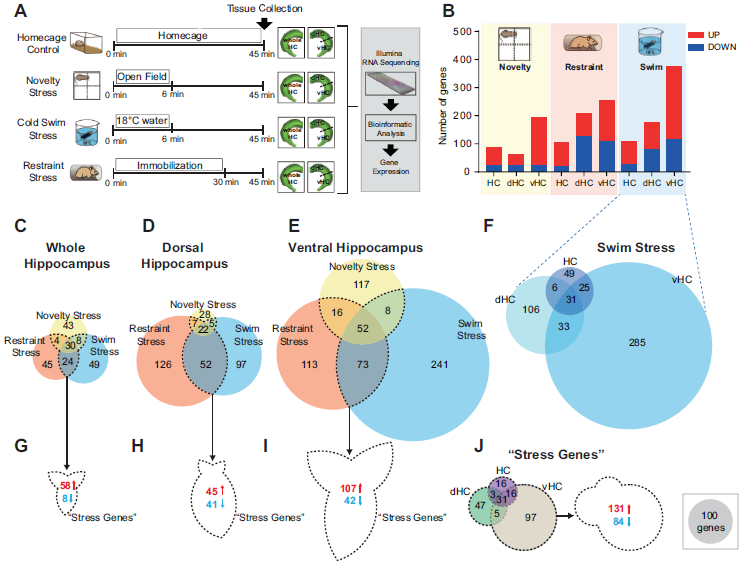
鉴于在dHC和vHC之间观察到的显著分子差异,作者假设应激刺激将在两种海马体区域中引起不同的分子反应。于是,作者将小鼠暴露于三种常见的应激之中(新奇感应激、束缚应激、冷水游泳应激),并和笼养对照小鼠一起处死,收集海马体组织,即海马体整个组织(HC)、dHC、vHC,进行转录组测序,发现大约100个基因对HC中的每个胁迫条件均有强烈表达量反应(p <0.005,log2FC >±0.3),且多数基因表达上调(图5B)。一个意想不到的发现是,三种压力因素导致了不同的基因表达谱,在整个HC、dHC和vHC中,每个应激源独特调节的基因数量远远大于交集基因的数量(图5C-E)。作者将3个刺激中至少响应2种刺激的基因称为应激基因,通路分析结果表明,上调的应激基因与转录调控相关,下调的应激基因与细胞粘附以及细胞连接相关。
图5 HC、dHC、vHC的压力诱导下转录组学变化
转录组学分析表明,vHC对应激诱导的变化较dHC更加敏感,vHC组的应激基因更多,随后作者继续研究蛋白质组水平上是否也能观察到vHC的应激敏感性增加的现象。因为冷水游泳应激总体上诱导了最强的基因表达变化,特别是在vHC中(图5F),并且蛋白质水平变化比mRNA水平更慢,因此作者决定在冷水游泳应激暴露后24小时测量蛋白质水平。结果发现,同转录组的表达趋势一致,vHC的高应力敏感性仍然可以在蛋白质组水平上检测到。
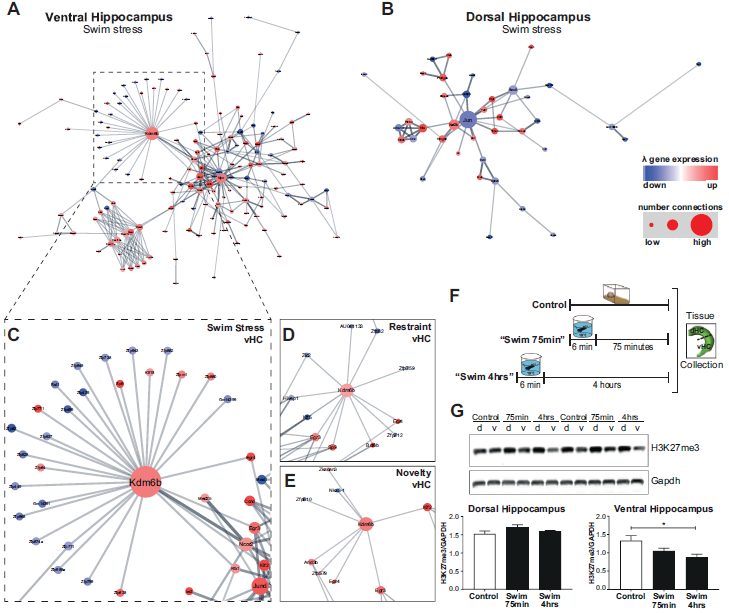
4. 蛋白互作网络分析
为了更好地理解dHC和vHC中应激差异调节的分子网络和过程,作者进行PPI互作网络分析。结果表明,与dHC相比,在vHC观察到更大的相互作用网络(图6A,6B),其特有表观遗传学簇Kdm6b(特异性抑制组蛋白H3K27me3的组蛋白去甲基化酶)响应vHC中的所有压力因素(图6C-E)。WB检测冷水游泳应激后H3K27me3的水平,发现 dHC中H3K27me3表达水平不变,而vHC中H3K27me3表达明显下调(图6F,6G)。
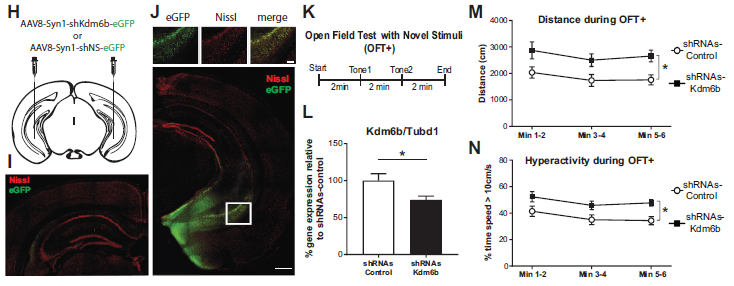
为了研究体内vHC中Kdm6b的敲低是否会对行为产生影响,作者对腹部海马区的Kdm6b进行RNAi干扰(shRNAs-Kdm6b)。手术后4周,在vHC中证实了病毒表达(图6J),而在dHC中没有病毒表达(图6I,6J)。与对照小鼠相比,shRNAs-Kdm6b小鼠vHC全组织裂解物中的Kdm6b mRNA水平降低(图6L),运动时更容易激动,过度活跃。这表明vHC神经元中的Kdm6b似乎对维持意外刺激的正常行为反应至关重要。
文章小结
海马体的dHC和vHC两个区域具有不同的压力应答分子反应,并且vHC对压力的刺激响应更加敏感。单独分析海马体不同区域大大提高了检测应力诱导变化的灵敏度。此外蛋白质互作网络分析揭示了限制于vHC的组蛋白去甲基化酶Kdm6b周围的应激反应表观遗传网络,并且急性应激降低了其酶靶H3K27me3的甲基化,vHC中选择性Kdm6b敲低可导致小鼠行为过度活跃。这些发现强调了在进行高通量分子分析时分别考虑背侧和腹侧海马的重要性,对基础研究和临床研究具有重要意义。
解析文献
Floriou-Servou A, von Ziegler L, et al. Distinct Proteomic, Transcriptomic, and Epigenetic Stress Responses in Dorsal and Ventral Hippocampus. Biological Psychiatry, 2018, 84(7):531-541
参考文献
1. Zubarev RA . The challenge of the proteome dynamic range and its implications for in-depth proteomics. Proteomics, 2013, 13:723–726.
2. Humphrey SJ, Azimifar SB, Mann M. High-throughput phosphoproteomics reveals in vivo insulin signaling dynamics. Nat Biotechnol , 2015, 33:990–995.
3. Crutchfield CA, Thomas SN, et al.Advances in mass spectrometry-based clinical biomarker discovery. Clin Proteomics, 2016, 13:1
4. Szklarczyk D, Morris JH, et al. The STRING database in 2017: Quality-controlled protein–protein association networks, made broadly accessible. Nucleic Acids Res, 2017, 45:D362–D368.
如何低成本研究空间转录组?看完这篇文章你或许会有答案
(2022-06-02T14:51 浏览数:15033)
【周二晚八点】从位置到功能--空间转录组应用
(2022-05-16T08:59 浏览数:15439)
Cell Reports:利用空间转录组解析哺乳动物精子生成
(2022-04-28T14:54 浏览数:18380)
RNA二级结构调控基因表达的研究现状和进展
(2022-04-21T13:39 浏览数:14232)
Nature: MERFISH绘制小鼠初级运动皮层空间细胞图谱
(2022-04-18T13:24 浏览数:14057)
大自然的恩赐-外泌体药载
(2022-04-08T13:43 浏览数:15022)
【详解】基于图像的单细胞空间分辨转录组学技术
(2022-04-01T11:18 浏览数:18806)
知无不“研”,五分钟带你了解空间分辨转录组学的前世今生
(2022-03-18T14:00 浏览数:15727)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:13597)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:14006)