近年来研究表明缺血后血管生成是血流恢复和缺血组织修复的关键。N6 -甲基腺苷(m6A)在许多生物过程中起着重要作用,但m6A对缺血后血管生成的影响及相关机制尚不完全清楚。本期分享云序客户上海中山医院心内科葛均波院士课题组发表的“Loss of m6A demethylase ALKBH5 promotes post-ischemic angiogenesis via post-transcriptional stabilization of WNT5A”文章,运用MeRIP-seq和RNA-seq的方法探讨了ALKBH5在缺血性血管生成中的作用,证明其通过m6A依赖的方式调控WNT5A mRNA转录后调节和稳定,该结果发现靶向ALKBH5可能是包括外周动脉疾病在内的缺血性疾病的潜在治疗选择,为揭示m6A修饰在缺血性血管生成中发挥作用进行助力,从而为人们治疗外周动脉疾病在内的缺血性疾病提供了新的思路。

影响因子:7.919
研究方法:m6A meRIP-seq、RNA-seq、qPCR
文章链接:Loss of m6A demethylase ALKBH5 promotes post-ischemic angiogenesis via post-transcriptional stabilization of WNT5A
研究内容
(1)缺氧损害血管生成能力并在CMECs中上调ALKBH5的表达
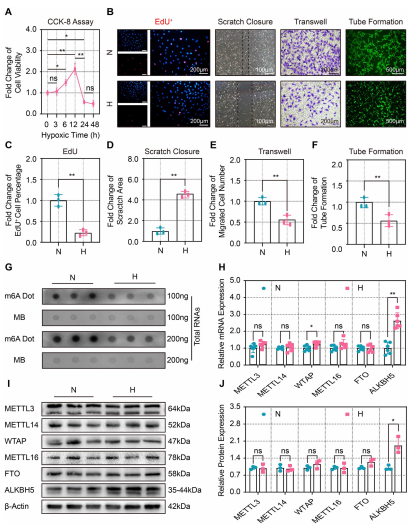
为了阐明m6A在缺血后血管生成中的作用,作者检测了缺氧损伤对CMECs血管生成表型的影响。CCK-8检测显示,CMECs活力在缺氧3 h后升高,12 h达到峰值,24 h后明显下降(图1A)。采用EdU检测细胞增殖,缺氧24 h后EdU阳性细胞比例显著降低(图1B和1C)。划痕和迁移试验显示缺氧显著减少了愈合面积(图1B和1D)和迁移CMECs的数量(图1B和1E)且显著损害了CMECs的血管形成能力(图1B和1F)。综上所述,缺氧24 h可抑制CMECs细胞增殖、迁移和血管生成。为了确定m6A是否参与了这一过程,进行了点印迹实验发现m6A的丰度在缺氧的CMECs中显著降低(图1G)。RT-qPCR检测了甲基化相关酶在缺氧CMECs中的mRNA表达水平的变化,发现甲基转移酶WTAP和去甲基化酶ALKBH5在缺氧损伤后显著上调(图1H)。Western blot分析进一步证实在低氧CMECs中,ALKBH5表达显著上调(图1I和1J)。
(2)ALKBH5过表达加重了缺氧诱导的CMECs功能障碍
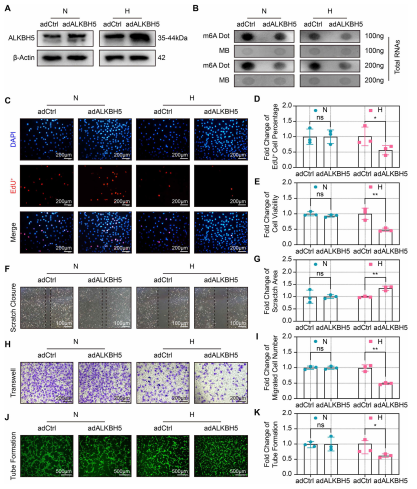
缺氧诱导的ALKBH5是否参与了血管生成?作者对ALKBH5过表达,并通过Western blot(图2A)证实过表达效率。缺氧条件下ALKBH5过表达CMECs中m6A丰度降低(图2B)。EdU和CCK-8测定结果表明缺氧条件下ALKBH5过表达抑制CMECS增殖(图2C和2D)和细胞活力(图2E)。Scratch和transwell检测也显示,在缺氧条件下过表达ALKBH5抑制CMECs的迁移能力(图2F和2I)。此外,ALKBH5过表达在缺氧条件下破坏了血管的形成(图2J和2K)。这些结果表明,虽然ALKBH5上调在常氧条件下可能不会显著影响CMECS功能,但在缺氧条件下会严重加剧CMECS功能障碍,从而导致血管生成受损。
(3)ALKBH5下调可减轻缺氧诱导的CMECs功能障碍
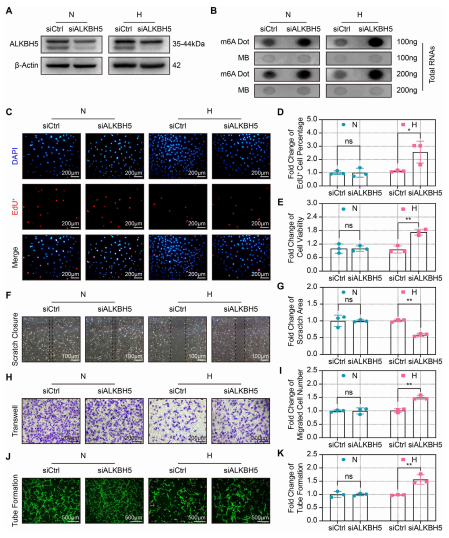
为了进一步研究ALKBH5在血管生成中的作用,作者用siRNA敲除了ALKBH5(图3A)。斑点杂交实表明,在常氧和缺氧条件下ALKBH5 KO中m6A整体水平显著升高(图3B)。EdU和CCK-8检测显示,在缺氧条件下ALKBH5 KO可以提高CMECs的增殖和活力(图3C-3E),增强CMECs的迁移(图3F-3I)。同样地,缺氧条件下ALKBH5 KO促进CMECs管的形成,而在常氧状态下则没有(图3J和3K)。上述数据表明,ALKBH5 KO在缓解缺氧诱导的内皮血管生成损伤中起着关键作用。
(4) MeRIP-seq联合RNA-seq揭示了ALKBH5的潜在靶基因
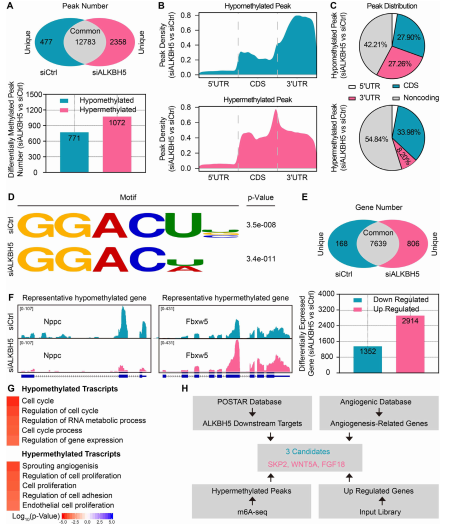
为探讨缺氧条件下ALKBH5抑制内皮血管生成的机制,在缺氧条件下转染对照或ALKBH5 siRNA后,将MeRIP-seq和RNA-seq联合应用于CMECs中。MeRIP-seq共发现12783个共同峰,对照组特有477个峰ALKBH5-KO 有,2358个特有峰。此外,发现771个低甲基化峰和1072个高甲基化峰(图4A)。MeRIP-seq进一步揭示了差异甲基化mRNA峰的分布特征(图4B)和百分比(图4C)。基于这些数据对两组CMECs进行了motif分析(图4D)。富集基因的差异表达分析显示1352个基因表达下调,2914个基因表达上调(图4E)。结合MeRIP-seq分析,natriuretic,peptide C 和 FBXW5分别被鉴定为具有代表性的低甲基化和高甲基化基因(图4F)。GO分析发现低甲基化基因主要参与细胞周期和RNA代谢等过程。而高甲基化基因主要富集在血管生成和细胞增殖调控中(图4G)。这些结果进一步证实了ALKBH5 KO诱导m6A高甲基化增强血管生成。POSTAR 、血管生成数据库、以及MeRIP-seq数据、RNA-seq数据结合鉴定了调控血管生成的ALKBH5靶基因。所得结果显示SKP2、WNT5A和FGF18是有待进一步研究的潜在促血管生成ALKBH5靶基因(图4H)。
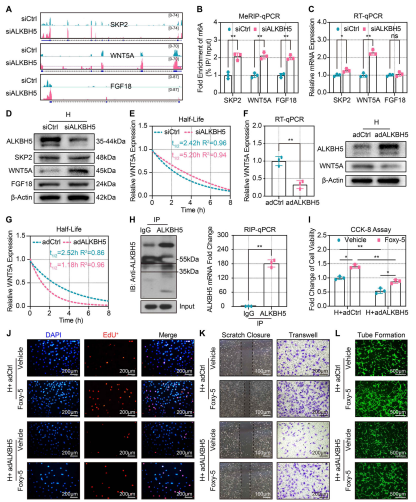
(5)ALKBH5调控WNT5A mRNA的稳定性和衰减
MeRIP-seq数据显示,ALKBH5敲除后SKP2、WNT5A和FGF18 mRNA的m6A丰度显著增加(图5A)。MeRIP-qPCR也对此结果进行了证实(图5B)。为了进一步检测m6A是否影响目的基因的表达,RT-qPCR和Western blot分析发现ALKBH5 KO增加了WNT5A表达(图5C, 5D)。RT-qPCR与放线菌素D检测不同时间点CMECs中WNT5A mRNA的稳定性和衰减,结果显示添加放线菌素D后,WNT5A的表达量呈随时间下降。然而,与对照组相比,ALKBH5敲除显著延迟了WNT5A mRNA的降解,从而延长了其半衰期(图5E)。为了进一步探讨ALKBH5对WNT5A mRNA的调控作用,作者评估了在缺氧CMEC中ALKBH5过表达后的WNT5A mRNA表达和稳定性。结果发现,过表达ALKBH5显著降低了WNT5A在蛋白和mRNA水平的表达(图5F),缩短了WNT5A mRNA的半衰期,降低了WNT5A mRNA的稳定性(图5G)。通过RIP-qPCR实验,发现ALKBH5与WNT5A mRNA结合(图5H)。这些数据表明,ALKBH5通过去除转录后m6A修饰,促进WNT5A mRNA的衰变并降低其半衰期。是否ALKBH5介导的血管生成依赖于WNT5A?CCK-8和EdU检测显示Foxy-5显著逆转了ALKBH5过表达对CMECs增殖的抑制作用(图5I、5J)。此外,Foxy-5显著消除了过表达ALKBH5后对CMECs迁移的抑制(图5K)。血管形成实验证实Foxy-5恢复了ALKBH5过表达受损的CMECs细胞的血管形成能力(图5L)。因此,WNT5A是ALKBH5的靶标mRNA。缺氧时ALKBH5通过破坏和衰变WNT5A mRNA,从而抑制血管生成能力。
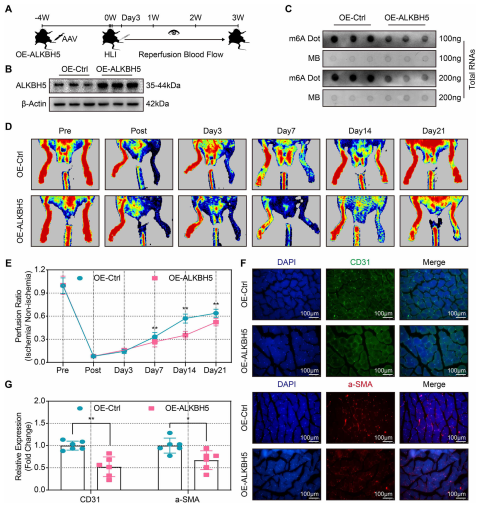
(6)ALKBH5过表达减弱缺血损伤后的血流量恢复和血管生成
为了研究ALKBH5对缺氧时体内血管生成的影响,在小鼠后肢缺血前4周,通过在小鼠腓肠肌注射AAV获得了ALKBH5的持续过表达。在后肢缺血前以及后肢缺血后21天内评估了ALKBH5过表达效率、m6A水平、血流速率和血管生成标志物的表达(图6A)结果显示,在注射过表达ALKBH5 AAV后,ALKBH5 mRNA和ALKBH5蛋白(图6B)显著上调。此外,过表达ALKBH5后,m6A丰度显著降低(图6C)。与对照组相比,在后肢缺血后第7-21天,过表达ALKBH5的小鼠血流恢复率明显降低(图6D和6E)。此外,与对照组相比,长期过表达ALKBH5的小鼠中CD31和α-SMA的表达水平也显著下调(图6F和6G),它们分别表明毛细血管和小动脉的密度。因此,过表达ALKBH5会减弱血流恢复和缺血后血管生成。
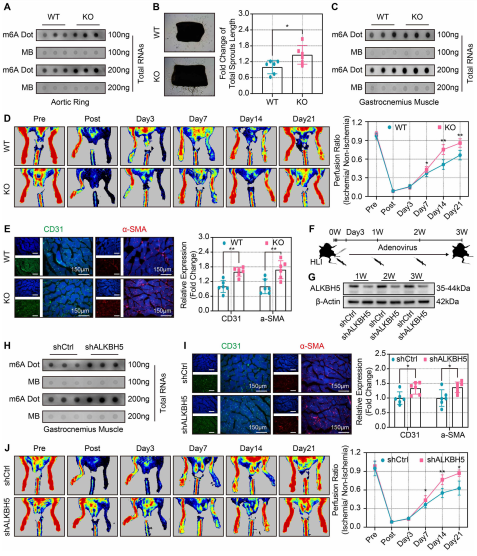
(7)ALKBH5基因敲除和腺病毒抑制表达增加了血管生成,改善了缺血损伤后的血流恢复
作者采用体外血管萌发模型和体内后肢缺血模型来验证ALKBH5的血管生成调节作用。点印迹实验显示,在ALKBH5 KO小鼠的主动脉环和腓肠肌组织中,m6A丰度显著增加(图7A、7C)。与同窝幼鼠相比,KO小鼠表现出更强劲的血管发育(图7B)。同样的,ALKBH5 KO小鼠后肢缺血后第7-21天血流恢复明显增强(图7 D)。此外,与WT小鼠相比,ALKBH5 KO小鼠腓肠肌中CD31和α-SMA的表达也显著上调(图7E)。这些结果表明,ALKBH5 KO对缺血后血管生成具有保护作用。作者通过腺病毒注射WT小鼠腓肠肌对ALKBH5进行了当即、后肢缺血7天和14天的短暂下调(图7F)。腺病毒注射后1周、2周和3周,ALKBH5 mRNA和ALKBH5蛋白的表达均显著降低(图7G)。此外,在ALKBH5敲除后,点印迹实验显示腓肠肌m6A水平在缺血后3周显著升高(图7H)。在敲除ALKBH5后,缺血腓肠肌中CD31和-SMA的表达水平显著升高(图7I)。同时ALKBH5敲除小鼠血流恢复明显改善(图7j)。总之,这些结果阐明了ALKBH5在缺血后血管生成中的关键作用,并揭示了敲除或抑制ALKBH5表达的潜在优势。未来的研究需要进一步验证以促进临床缺血损伤后的血管生成。
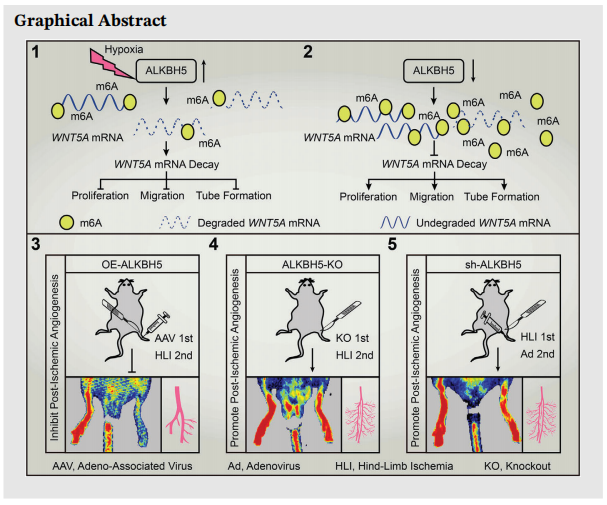
点评:文章通过m6A-meRIP-Seq结合全转录组测序技术(云序提供),通过对测序结果比对分析确认m6A甲基化修饰在缺氧后血管生成中起着重要作用。其中去甲基化酶ALKBH5以依赖于m6A修饰的方式调控WNT5A的表达,从而降低其稳定性,进而阻碍了缺氧CMECs中的血管生成。这些发现说明靶向ALKBH5可能成为包括外周动脉疾病在内的缺血性疾病的潜在治疗选择。为促进缺氧损失后血管生成提供新的思路。
01 m6A RNA修饰测序
m6A RNA修饰测序(m6A-meRIP-seq)
对m6A RNA甲基化,目前最流行的检测手段为m6A-Seq技术,适用于m6A RNA甲基化谱研究,快速筛选m6A RNA甲基化靶基因。云序可提供mRNA和多种非编码RNA的m6A测序:
- m6A 全转录组测序(涵盖mRNA,LncRNA,circRNA)
- m6A LncRNA测序(涵盖LncRNA和mRNA)
- m6A Pri-miRNA测序(涵盖Pri-miRNA和mRNA)
- m6A mRNA测序
- m6A miRNA测序
LC-MS/MS检测整体RNA修饰水平
精准高效,可以实现一次检测,9类修饰水平检测,一步到位。
比色法检测整体RNA修饰水平
快速检测m6A整体甲基化水平
03 m6A RNA修饰上游酶的筛选
m6A RNA修饰相关酶PCR芯片
寻找上游直接调控m6A RNA甲基化的甲基转移酶。
04 m6A RNA修饰靶基因验证
meRIP-qPCR
云序提供各类不同修饰的meRIP-qPCR服务,可针对mRNA,lncRNA,环状RNA等不同类型的RNA分子进行检测,低通量验证RNA修饰靶基因表达水平。
05机制互作研究
5.1 RIP-seq/qPCR
筛选或验证RNA修饰直接靶点,研究RNA修饰靶基因的调控机制。
5.2 RNA pull down -MS/WB
筛选或验证目标RNA互作基因或蛋白,研究相应的分子调控机制。
5.3 双荧光素酶实验
验证两基因互作,研究相应的分子调控机制。
5.4 ChIP-seq
筛选或验证目标蛋白与DNA互作,研究相应的分子调控机制。
云序生物服务优势
优势一:发表10分以上文章最多的m6A RNA甲基化测序服务平台。云序已累计支持客户发表47篇高水平文章,合计影响因子300分+,是国内支持发文最多、累计影响因子最高的公司。
优势二:至今完成4000+例 m6A测序样本,全面覆盖医口、农口等各类样本。
优势三:全面检测mRNA和各类非编码RNA(circRNA,lncRNA,Pri-miRNA等)。
优势四:独家提供m6A一站式服务:m6A整体水平检测、m6A测序、MeRIP-qPCR验证、RIP和RNA pull-down。
优势五:率先研发超微量meRIP测序技术,RNA量低至500ng起。
优势六:国内最全的RNA修饰测序平台,提供m6A、m5C、m1A、m7G、m3C、O8G、ac4C乙酰化和2'-O-甲基化测序。
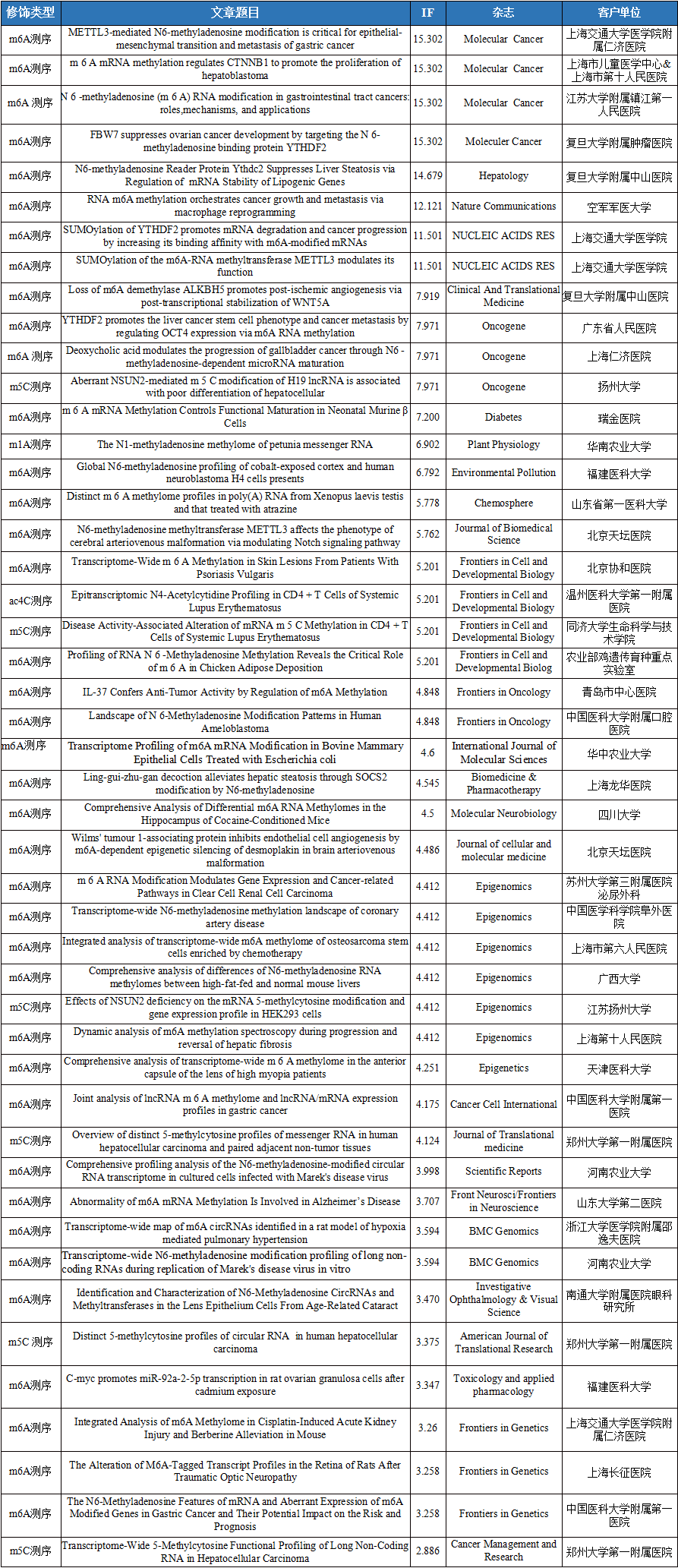
云序客户RNA修饰文章列表
相关产品
上海云序生物科技有限公司 商家主页
地 址: 上海市松江区莘砖公路518号24号楼4楼
联系人: 戴小姐
电 话: 021-64878766
传 真: 021-64878766
Email:market@cloud-seq.com.cn;liuqingqing@cloud-seq.com.cn
