氢化反应是一种非常常见的反应,其中H2可以通过双键或三键引入,在实验室和工业生产中均得到了广泛的应用。这种反应通常需要在金属催化剂存在的条件才能进行,在这类催化剂的催化下,它被称为催化还原或催化氢化。这些反应条件也同样适用于苯基和苯氧羰基的脱保护。
加氢催化剂包括了非均相催化剂,如钯/木炭(Pd/C);均相催化剂,如威尔金森催化剂,以及不对称加氢催化剂,并在许多情况下被使用。本篇技术文章主要对各种加氢催化剂进行了概述。
加氢催化剂
催化还原被广泛应用于碳-碳键的加氢、硝基的还原以及苯基和苯氧羰基的去除[1]。其中铂金属以多种形式被使用,如Pd/C共催化剂,还有威尔金森催化剂[W106045][2-4]和克拉布特里催化剂[C130061][5]。Wilkinson催化剂和Crabtree催化剂都能选择性地加氢烯烃和炔烃。此外,由于其具有配位官能团,Crabtree催化剂还具有立体选择性加氢的作用[6]。


1. Shvo催化剂
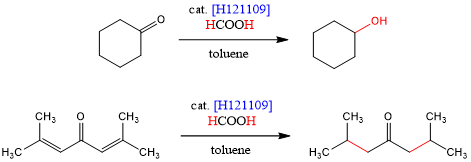
Shvo的团队报道了一种钌双核配合物[H121109],它能利用甲酸作为氢源,发生催化羰基和烯烃分子的氢化反应[7]。当α,β-不饱和酮利用Shvo催化剂进行还原时,烯烃部分会选择性氢化。

2. 钌络合物催化剂
钌催化剂[C282669]能将酯还原为醇。在这样的反应条件下,可以选择的溶剂范围很广,即使在简单的条件下也可以进行氢化反应[8]。然而在这样的条件下,通常一些通过常规条件会被去除的苄基和苯氧羰基也会被保留。此外,[C282669]催化剂还能使醛、酰胺和腈氢化[9]。


3. 锰络合物催化剂
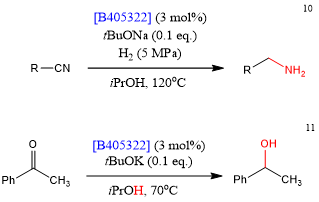
Beller的研究小组报道了锰络合物[B405322]是非常有助于腈加氢催化剂[10]。该络合物还可以通过从异丙醇中转移出来的氢原子来催化酮的还原[11]。

4. 铑催化剂用于芳香环的顺式选择性加氢反应
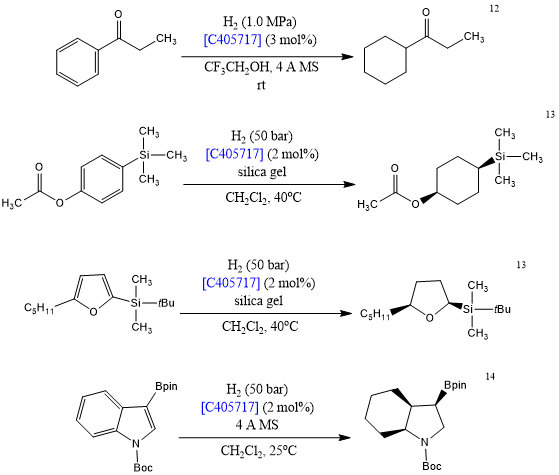
(环己基-CAAC)Rh(COD)Cl [C405717]是一种高效、具有选择性的芳香加氢催化剂。C405717可用于环己烷部分的合成,同时仍保留羰基[12]、硅基[13]、和硼基[14]等多种官能团。在这些条件下,能够选择性地提供顺式饱和烃。

5. 无金属氢化的有机催化剂
1,8-双(二苯基膦)萘[B152147]含有两个二苯基膦基团,并且是一个常见的大分子路易斯碱。B152147的体积也可以通过类似三(五氟苯基)硼烷[T109495]的路易斯酸处理而有效地形成未淬灭的路易斯酸碱对,即“受阻路易斯对(FLPs)”。Erker等人已经将它们应用于激活氢分子并且和硅烯醇醚进行无金属加氢反应。在这个反应中,氢分子被由FLP诱导的酸碱协同作用激活了[15]。

不对称氢化催化剂
Noyori等人报道了具有手性2,2'-双(二苯基膦)-1,1'-二萘基(BINAP)配体的金属配合物可以作为烯烃部分不对称加氢的催化剂,具有高收率和对映选择性[16, 17]。这种方法已被用于制造芳香化学品和药物。
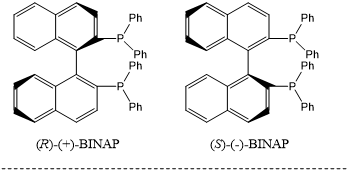

含有BINAP片段的催化剂具有较高的转化率(TON),C282701等催化剂的TON数值可达100000[18]。目前,研究人员已开发出多种类型的BINAP类似物。类似地,催化剂D282716已经被用作于不对称胺化反应以及酮和烯烃的还原了[19]。

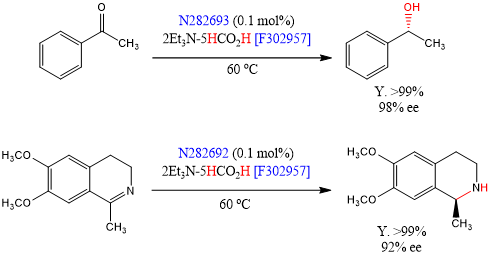
Ikariya等人报道了以甲酸盐[F156751]为质子源、手性二胺配体为钌催化剂[N282693] [N282692]的不对称氢化反应[20]。传统的催化剂通常需要高压条件,但这些催化剂可以在常压下使物质氢化,而不需要其他特殊的设备。
参考文献
1) review: a) R. E. Harmon, S. K. Gupta, D. J. Brown, Chem. Rev. 1973, 73, 21. https://doi.org/10.1021/cr60281a003
b) B. R. James, Adv. Organomet. Chem. 1979, 17, 319. https://doi.org/10.1039/IC9797600189
c) H.-U. Blaser, Christophe, M. B. Pugin, F. Spindler, H. Steiner, M. Studer, Adv. Synth. Catal. 2003, 1-2, 103. https://doi.org/10.1021/ja7102422
2) J. F. Young, J. A. Osborn, F. H. Jardine, G. Wilkinson, Chem. Commun. 1965, 131. https://doi.org/10.1039/C19650000131
3) J. A. Osborn, F. H. Jardine, J. F. Young, G. Wilkinson, J. Chem. Soc. A 1966, 1711. https://doi.org/10.1039/J19660001711
4) S. Mahboobi, K. Bernauer, Helv. Chim. Acta 1988, 71, 2034. https://doi.org/10.1016/0957-4166(94)80122-3
5) R. H. Crabtree, M. W. Davis, J. Org. Chem. 1986, 51, 2655. https://doi.org/10.1021/jo00364a007
6) R. H. Crabtree, M. W. Davis, Organometallics 1983, 2, 681. https://doi.org/10.1016/0022-328X(88)83154-1
7) N. Menashe, E. Salant, Y. Shvo, J. Organomet. Chem. 1996, 514, 97. https://www.sciencedirect.com/journal/journal-of-organometallic-chemistry/vol/514/issue/1
8) W. Kuriyama, T. Matsumoto, O. Ogata, Y. Ino, K. Aoki, S. Tanaka, K. Ishida, T. Kobayashi, N. Sayo, T. Saito, Org. Process Res. Dev. 2012, 16, 166. https://doi.org/10.1021/op200234j
9) J. Neumann, C. Bornschein, H. Jiao, K. Junge, M. Beller, Eur. J. Org. Chem. 2015, 27, 5944. https://doi.org/10.1002/ejoc.201501007
10) S. Elangovan, C. Topf, S. Fischer, H. Jiao, A. Spannenberg, W. Baumann, R. Ludwig, K. Junge, M. Beller, J. Am. Chem. Soc. 2016, 138, 8809. https://doi.org/10.1021/jacs.6b03709
11) M. Perez, S. Elangovan, A. Spannenberg, K. Junge, M. Beller, ChemSusChem 2017, 10, 83. https://doi.org/10.1002/cssc.201601057
12) Y. Wei, B. Rao, X. Cong, X. Zeng, J. Am. Chem. Soc. 2015, 137, 9250. https://doi.org/10.1021/jacs.5b05868
13) M. P. Wiesenfeldt, T. Knecht, C. Schlepphorst, F. Glorius, Angew. Chem. Int. Ed. 2018, 57, 8297. https://doi.org/10.1002/anie.201804124
14) M. Wollenburg, D. Moock, F. Glorius, Angew. Chem. Int. Ed. 2018, 57, 1. https://onlinelibrary.wiley.com/toc/15213773/2018/57/1
15) H. Wang, R. Fröhlich, G. Kehr, G. Erker, Chem. Commun. 2008, 5966. https://doi.org/10.1039/B813286K
16) A. Miyashita, A. Yasuda, H. Takaya, K. Toriumi, T. Ito, T. Souchi, R. Noyori, J. Am. Chem. Soc. 1980, 102, 7932. https://doi.org/10.1021/ja00547a020
17) T. Ohta, H. Takaya, M. Kitamura, K. Nagai, R. Noyori, J. Org. Chem. 1987, 52, 3174. https://doi.org/10.1021/jo00390a043
18) K. Matsumura, N. Arai, K. Hori, T. Saito, N. Sayo, T. Ohkuma, J. Am. Chem. Soc. 2011, 133, 10696. https://doi.org/10.1021/ja202296w
19) G. F. Busscher, L. Lefort, J. G. O. Cremers, M. Mottinelli, R. W. Wiertz, B. de Lange, Y. Okamura, Y. Yusa, K. Matsumura, H. Shimizu, J. G. de Vries, A. H. M. de Vries, Terahedron: Asymm. 2010, 21, 1709. https://doi.org/10.1016/j.tetasy.2010.04.013
20) T. Touge, T. Hakamata, H. Nara, T. Kobayashi, N. Sayo, T. Saito, Y. Kayaki, T. Ikariya, J. Am. Chem. Soc. 2011, 133, 14960. https://doi.org/10.1021/ja207283t
阿拉丁提供相关产品,详情请见阿拉丁官网:Hydrogenation Catalysts (aladdin-e.com)

