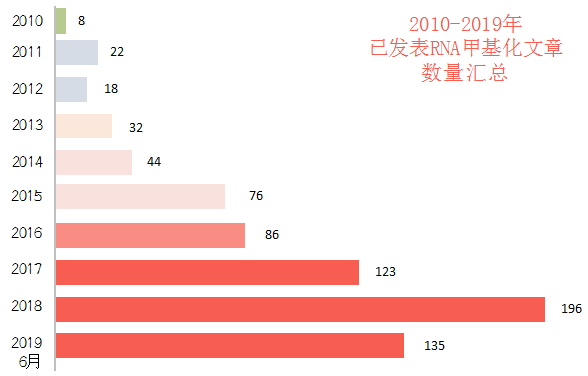
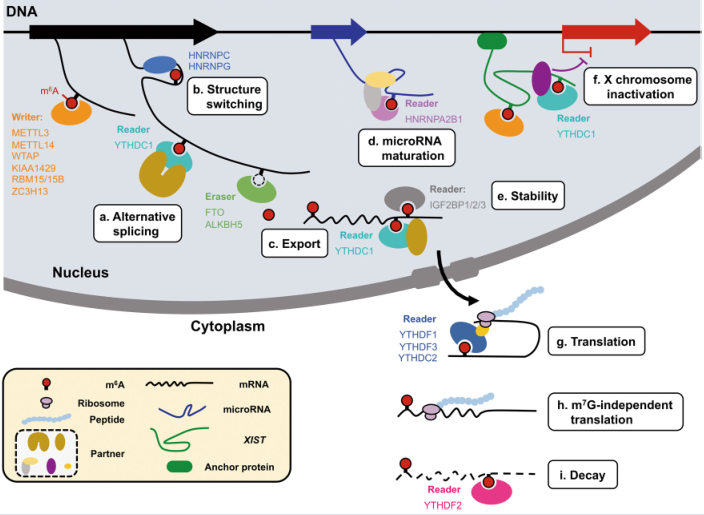
做腻了writer,eraser?那让我们来看看reader,YTHDF家族由于在核外参与蛋白翻译和降解,是reader里最明星的研究对象,可m6A reader酶千千万万,您研究的基因除了YTHDF家族外,可能还与其他reader结合。

影响因子:7.8
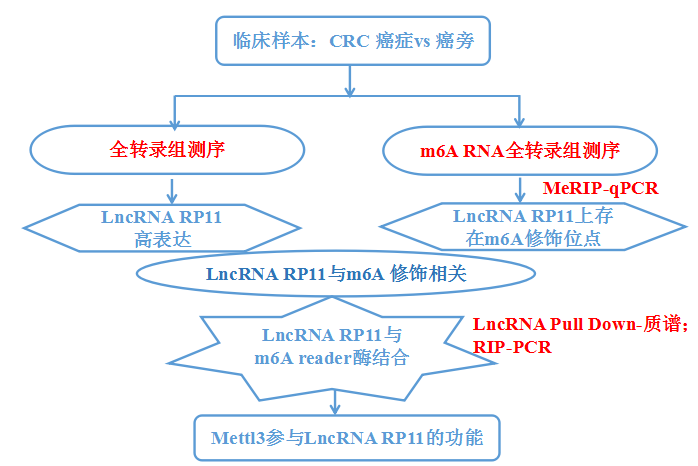
实验方法:LncRNA 测序,MeRIP-qPCR,RNA Pull Down,RIP,LncRNA定量PCR,mRNA定量PCR
实验材料:CRC临床样本等,结直肠癌细胞系等
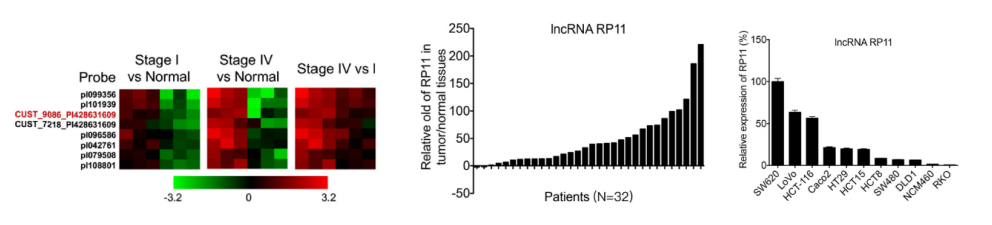
CRC组织(癌症1期和癌症3期)与癌旁组织分别进行LncRNA测序(云序可提供此服务),筛选到在癌症1期和3期都差异高表达的LncRNA---RP11。在测序样本和32个临床样本组织中,通过LncRNA 定量PCR证实其在实验组中高表达。已有结肠癌和直肠癌数据库结果也证实这类表达趋势。RP11在多个结直肠癌细胞系中广泛表达,并在CRC患者转移性淋巴结组织原代培养的SW620细胞中高表达。
为进一步阐明RP11在体内和体外的功能机制。作者首先证实RP11过表达细胞系能够显著促进细胞的迁移能力。由于此过程影响了E-Cad,FN和Vim等标志物蛋白的表达量,因此可能与EMT和癌症转移相关。接着,作者在异种移植肿瘤的裸鼠体内高表达RP11基因,发现该基因能够促进肿瘤的增殖。作者在裸鼠体内通过尾部注射方式,导入稳定高表达RP11的癌症细胞,饲养8周后,发现这些细胞转移至小鼠肝脏组织中。
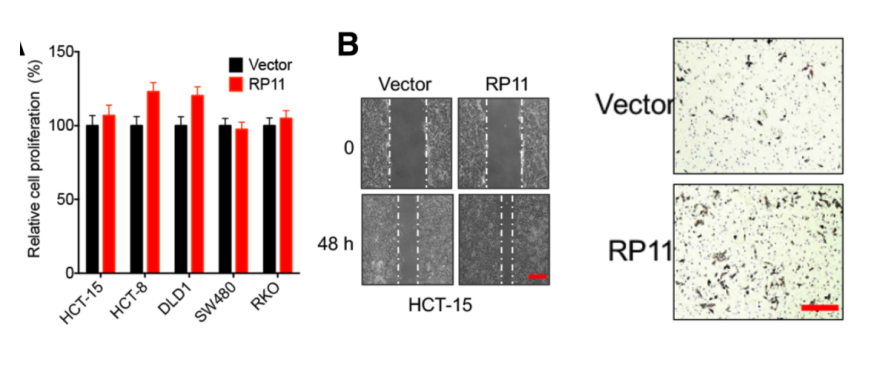
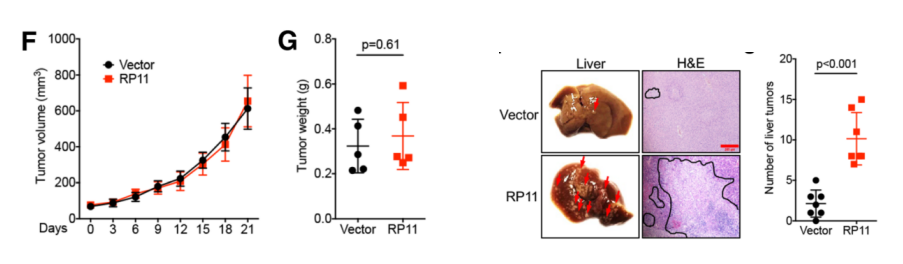
体内:RP11促进癌组织增殖和迁移
已有研究表明,LncRNA能够通过顺势调控机制影响其周围的转录本表达。因此,本研究在LncRNA RP11周围找到了6个转录本,分别为NUDT12, C5orf30, PPIP5K2, GIN1, RP11-6 N13.1和CTD-2374C24。通过mRNA定量PCR证实以上转录本不管是在RP11高表达组以及RP11表达量最高的SW620细胞系中,都未差异表达。所以,RP11的功能机制不是通过顺势调控的模式影响的。
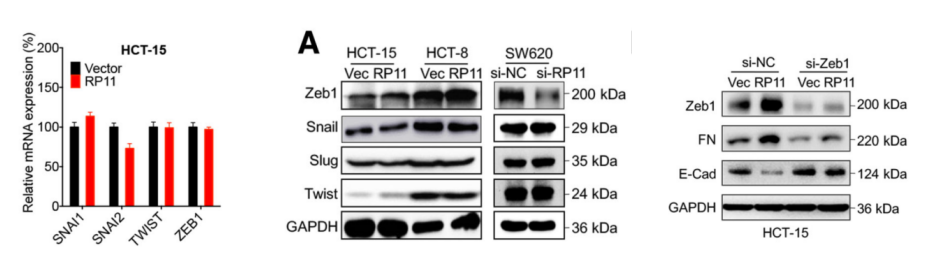
为了证实以上猜想,作者在过表达细胞中通过mRNA定量PCR技术,检测了多个与EMT相关因子的表达量,检测结果显示Zeb1与RP11的表达模式正相关。并且在Zeb1过表达细胞系中,证实能够影响FN和Vim标志物的表达量。因此,RP11的下游可能是Zeb1。
为了验证前面的猜想,作者通过Zeb1 RIP-LncRNA PCR(云序可提供此服务)和RP11 Pull Down-质谱技术(云序可提供此服务),证实Zeb1与RP11在mRNA和蛋白层面都不是直接结合的关系。
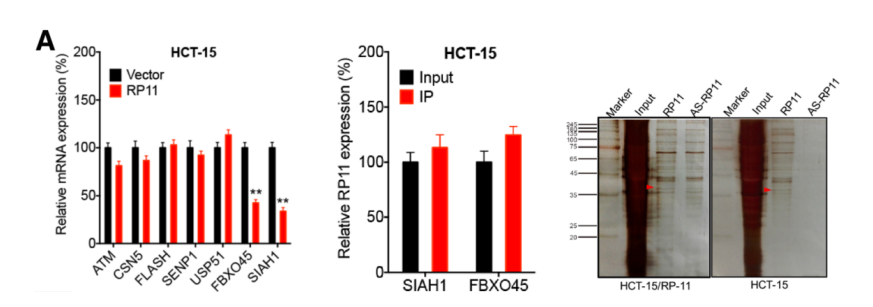
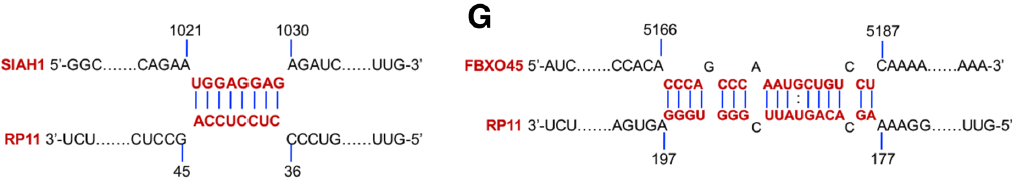
同样的,作者推测下游蛋白可能是Siah1和Fbxo45。在mRNA层面,通过RP11 RIP-mRNA PCR,证实两者调控了RP11和Zeb1的表达。在蛋白层面,通过RP11 Pull Down-质谱技术证实三者并非直接结合。
首先,作者怀疑RP11的高表达与DNA甲基化相关,通过DNA甲基化抑制酶处理细胞后,发现RP11表达量不变,证实在CRC细胞中RP11表达量与DNA甲基化无关。同时,实验也证实其与组蛋白乙酰化无关。
通对分析大量不同分期临床样本表达情况表明m6A修饰先调控RP11,RP11在影响Siah1-Fbxo45/Zeb1。借助KM曲线,作者发现高表达RP11直肠癌患者的生存情况并不乐观。同时,也分析了下游基因与病人其他临床指标间的关系。总体而言,证实了m6A/RP11/Zeb1促进了CRC的发生发展过程。
在本研究中,作者首先通过LncRNA高通量测序手段,在CRC疾病组中筛到高表达的LncRNA----RP11,并证实其能够促进肿瘤迁移。
随后,作者旨在研究RP11下游结合蛋白是什么,是如何调控促进迁移表型的。
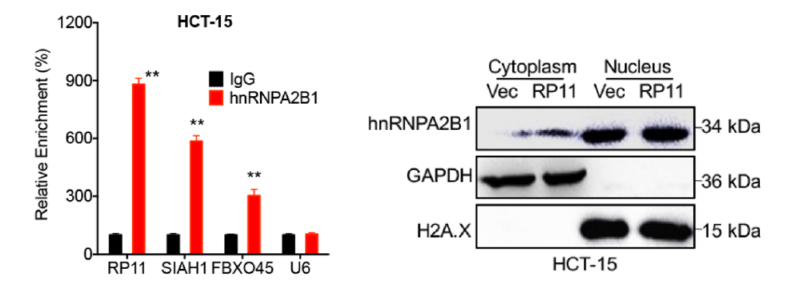
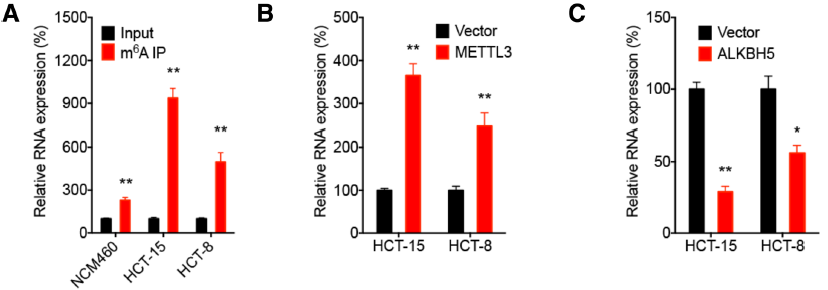
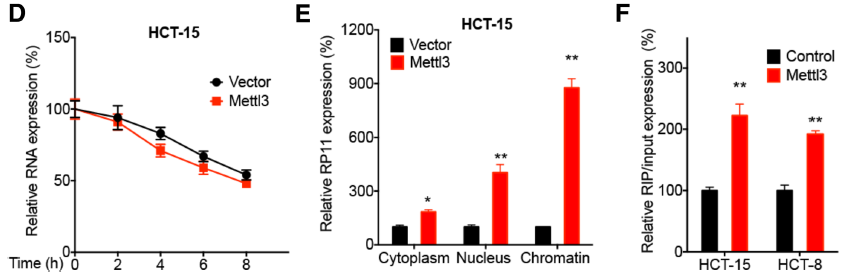
一方面:借助LncRNA Pull Down,快速锁定与RP11结合的蛋白就是m6A reader hnRNPA2B。通过RIP-PCR,快速找到与该蛋白结合的RNA是RP11。另一方面,借助MeRIP-qPCR,证实在3种疾病相关细胞系中RP11上都存在着m6A 修饰的情况。同时,Mettl3作为其上游促进RP11稳定性,从而促进CRC的发生发展。
云序生物提供比色法检测整体m6A甲基化修饰水平、RNA甲基化测序、MeRIP-qPCR验证、RIP和RNA Pull Down机制研究服务。RNA甲基化测序技术是真正实现m6A,m5C和m1A修饰,检测分子除mRNA外,还能检测环状RNA,LncRNA及其他非编码RNA。2016年至今,样本数量累积超过5000+,MeRIP富集成功率高达98%以上。
现在,为解决客户样本量少的问题,特推出超微量MeRIP测序技术,500ng总RNA既可进行测序实验。特殊样本也可进行RNA甲基化测序,如血清,血浆,外泌体和石蜡样本。
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-019-1014-2
上海云序生物科技有限公司 商家主页
地 址: 上海市松江区莘砖公路518号24号楼4楼
联系人: 戴小姐
电 话: 021-64878766
传 真: 021-64878766
Email:market@cloud-seq.com.cn;liuqingqing@cloud-seq.com.cn
相关咨询
杨宝峰院士团队最新成果 | 云序助力揭示RNA修饰m7G调控心肌肥厚的机制研究 (2024-11-13T00:00 浏览数:2496)
Nature子刊| 重磅综述!一文总结「m6A修饰非编码RNAs」在各类肿瘤中的调控机制及作用 (暂无发布时间 浏览数:2320)
研究速览-eccDNA 2023年最新进展大放送! (暂无发布时间 浏览数:2135)
云序生物MeRIP-qPCR技术干货 (暂无发布时间 浏览数:2181)
技术干货| “eccDNA碱基序列的获取及引物设计”方法教程 (暂无发布时间 浏览数:2387)
云序客户m6A高分文章|揭示组蛋白乙酰化与m6A修饰在眼部黑色素瘤发生中的共同作用机制 (暂无发布时间 浏览数:2081)
Nat Biotechnol IF=47 | BID-seq:一种基于单碱基分辨率的假尿嘧啶(Ψ)修饰定量测序检测方法 (暂无发布时间 浏览数:1753)
北大伊成器团队Nature Reviews重磅发文:非m6A热门修饰调控与功能一文速览! (暂无发布时间 浏览数:2289)
用户文章m6A专题|IF=9.8|m6A去甲基化酶ALKBH5缺乏会加重钴致神经退行性损伤 (暂无发布时间 浏览数:1652)
客户文章| Nature子刊 揭示了FMR1通过m6A修饰调控早期胚胎发育的分子机制 (暂无发布时间 浏览数:2223)
