1
什么是树突状细胞(DC)?
DC细胞是“Dendritic Cell”,中文名称是树突状细胞。树突状细胞是人体内最有效的抗原递呈细胞(antigen presenting cell, APC)。DC细胞是唯一能够显著刺激初始T细胞增值的APC,其他种类的APC(如单核巨噬细胞,B细胞等)仅能刺激已活化的或者记忆性的T细胞,因此DC细胞是适应性T细胞免疫应答的始动者,在肿瘤免疫中发挥着及其重要的作用。
DC 表面高表达MHC -I和MHC -II类分子,具有特异性表面标志的细胞。其对抗原摄取,加工以及刺激T细胞使其激活,并最终决定T细胞的分化方向。
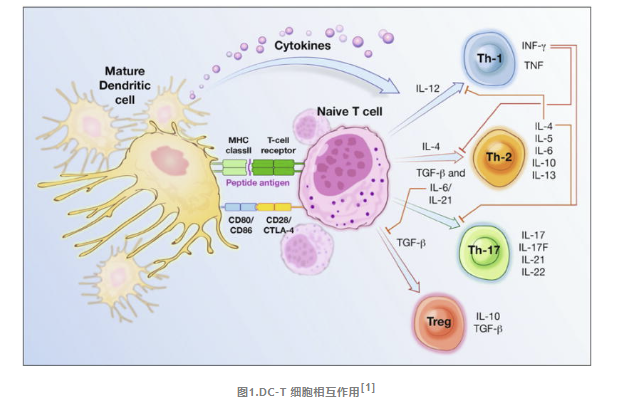
DC提供三个关键信号来激活初始 T 细胞并启动适应性免疫反应:
首先
DC 表面 p-MHC 复合物被抗原特异性 T 细胞受体 (TCR) 识别。
其次
共刺激相互作用发生在 DC CD80/CD86 分子和 T 细胞 CD28 分子之间。T 细胞还可能表达 CTLA-4 分子,该分子与 DC CD80/CD86 相互作用并传递抑制 T 细胞激活的信号。
最后
局部细胞因子的存在,活化的T 细胞可能最终分化为几种特殊亚型之一。其中包括 Th1、Th2、Th17 和 Treg 谱系。Th1、Th2 和 Th17 构成 T 细胞反应的“激活”臂,Treg 细胞形成“抑制”臂。
IL-12 刺激 Th1 细胞分化,产生 IFN-g,这是先天性和适应性免疫反应的重要激活剂,IL-4抑制Th1细胞的分化。IL-4促进Th2细胞的分化,Th2细胞分泌IL-4、IL-5、IL-6、IL-10和IL-13,激活嗜酸性粒细胞、肥大细胞和B细胞以支持体液免疫和寄生虫抵抗力。IFN-g 抑制 Th2 分化。Th17 细胞在 TGF-β和 IL-6 或 IL-21 存在的情况下发育。它们分泌 IL-17、IL-17F、IL-21 和 IL-22,在自身免疫组织炎症和对细胞外细菌感染的抵抗力的发展中发挥关键作用。TGF-β的存在促进调节性 T 细胞的发育。p-MHC-TCR 或共刺激相互作用(可能通过未成熟 DC 的抗原呈递发生)以及通过 DC 共抑制分子或 CTLA-4 激活传递抑制信号也可能诱导Treg 细胞分化。IL-6 抑制Treg细胞发育。Tregs分泌IL-10和TGF-β来抑制免疫反应。
2
DC的来源
DC细胞在体内含量甚微, 从体内直接分离出DC耗时而且细胞产量很低,这极大地限制了DC的研究和应用。但DC能从不同组织里的DC前体细胞分化、诱导而来, 如骨髓液的前体细胞,外周血和脐带血的单核细胞。
对于人,由于人外周血的取材最为方便且单核细胞数量最多,所以最常用的方法是从人外周血单个核细胞(PBMC)诱导DC。而对于小鼠,最常见的方法是从骨髓细胞诱导产生DC,即骨髓来源的DC(Bone Marrow-Derived Dendritic Cells,BMDC)。
3
DC分类
01
根据DC发育成熟状态,分为不同成熟阶段
Step1
从DC的祖细胞(如单核细胞)诱导分化为未成熟DC(immature DC,iDC)
Step2
从iDC诱导分化为成熟DC (mature DC,mDC)
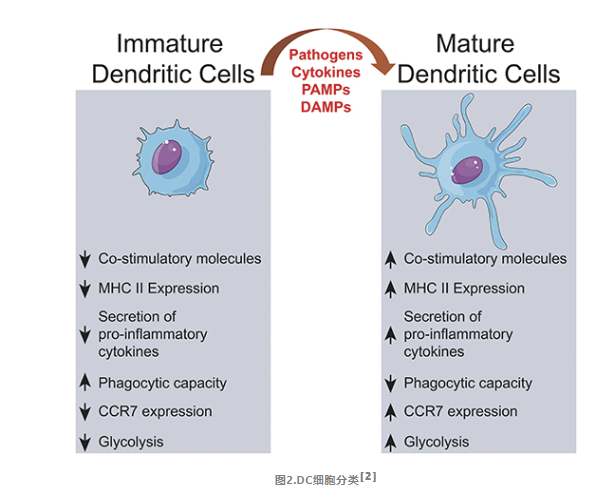
02
iDC和mDC的作用
DC的不同成熟状态决定了其在免疫应答中的作用,iDC具有很强的抗原摄取和加工能力。但抗原递呈能力很弱,不能活化T细胞。在体外培养时,iDC 去除细胞因子(即 GM-CSF 和 IL-4)后,会逆转为巨噬细胞。MHC -II类分子和共刺激分子CD80、CD86和CD40是DC成熟程度的指标。未成熟的DC低表达MHC -II类分子和共刺激分子CD80、CD86和CD40等。
成熟DC则正好相反,其抗原摄取和加工能力很弱,但具有很强的抗原递呈能力。因而可以激活 T 细胞,引起免疫反应。而且 DC 成熟后即使在培养体系中去除细胞因子,仍能保持 DC 的状态和功能,不会发生逆转。因此DC 必须完全成熟后才能用于免疫治疗。
4
DC培养原理
人源DC的培养主要是由外周血单核细胞与不同的细胞因子组合进行定向诱导产生。目前诱导DC产生的细胞因子组合有多种,如IL-4联合GM-CSF、TNF-α联合GM-CSF、IFN-α联合GM- CSF、IL-15联合GM-CSF、单独TSLP进行诱导等,由此产生的DC特性也各不相同。DC的前体细胞来源不同,采用的细胞因子组合也不尽相同。目前人源DC最常用的方法是GM-CSF联合IL-4诱导外周血单核细胞产生DC。
5
细胞因子的作用
GM-CSF和IL-4共同作用可使单核细胞定向分化为未成熟DC。TNF-α/IL-1β/IL-6 三因子组合可在无牛血清培养条件下诱导DC的完全成熟,从而制备出DC。
Step1:
01
GM-CSF (粒细胞巨噬细胞集落刺激因子)
(1)GM-CSF是一种造血生长因子,在体外可刺激中性粒细胞和巨噬细胞集落的形成,并具有促进早期红巨核细胞、嗜酸性祖细胞增殖和发育的功能;
(2)GM-CSF是最常用的DC细胞培养因子之一;
(3)它能够诱导单核细胞或DC前体细胞向DC分化,并促进DC的增殖和存活;
(4)GM-CSF还可以提高DC表面抗原水平,增强DC的抗原捕获和处理能力。
02
1. IL-4 (白细胞介素-4)
(1)单核细胞可分化为巨噬细胞、破骨细胞 (OC) 和树突状细胞 (DC)。
(2)IL-4 抑制单核细胞向CD14+巨噬细胞分化,从而诱导其分化为未成熟DC。若培养体系中不加 IL-4,单核细胞将分化为巨噬细胞。
(3)IL-4能够促使DC产生Th2型免疫反应相关的细胞因子,如IL-10和IL-13。
(4)IL-4 还可影响DC的表面标志物表达,使其具有更好的抗原递呈和T细胞活化能力。
GM-CSF和IL-4 共同作用可使单核细胞定向分化为未成熟DC,此时的DC具有较强的抗原摄取和加工能力,但抗原递呈能力很弱。细胞表面中度表达 MHC I 类、II 类分子和 B7 家族分子(CD80, CD86 等),但不表达或低表达CD14。
Step2:
03
TNF-α (肿瘤坏死因子-α)
TNF-α是一种早期炎症细胞因子,能够促使DC的分化和成熟,并增强其抗原递呈能力。它还能够激活NF-κB信号通路,促进DC产生其他炎症介质和细胞因子。
04
IL-1 (白介素-1)
(1)IL-1是一种早期炎症细胞因子,包括IL-1α和IL-1β两个亚型。
(2)在DC细胞培养中,IL-1β能够促进DC的分化和成熟。
(3)IL-1β刺激DC表达更多的共刺激分子(如CD40、CD80和CD86),增强其抗原递呈和T细胞活化能力。
(4)此外,IL-1也可以促进DC产生其他炎症细胞因子,如IL-12和TNF-α等。
05
IL-6 (白介素-6)
(1)IL-6是一种具有多种生物学功能的细胞因子。在DC细胞培养中,IL-6起着双重作用。
(2)一方面,IL-6可以促进DC的分化和成熟,提高其抗原递呈能力。
(3)另一方面,IL-6还可以影响DC的功能,如调节其分泌的细胞因子类型和数量。
(4)IL-6还可以调控DC与其他免疫细胞之间的相互作用,如与T细胞的活化和极化。
这 3 种细胞因子均可下调未成熟DC的巨胞饮作用和表面Fc受体的表达,使细胞内MHC II类分子区室消失,但能够上调细胞表面 MHC I类、II 类分子和B7家族分子(CD80, CD86 等)的表达,使未成熟DC分化为成熟DC,此时DC的抗原摄取和加工能力明显减弱,而抗原递呈能力显著增强,可极强地激活 T细胞。TNF-α,IL-1β和IL-6三因子组合可在无牛血清培养条件下诱导 DC 的完全成熟,从而制备出DC。
06
PGE2 (前列腺素 E2)
在 TNF-α,IL-1β、IL-6 成熟诱导组合中添加 PGE2,可进一步提高 DC 的产量、成熟度、迁移能力和免疫激活能力。DC 迁移能力的提高非常重要。因为TNF-α,IL-1β、IL-6 诱导成熟的DC迁移能力较弱,不能很好地到达淋巴结而激活T细胞。而添加PGE2后诱导成熟的DC因表面趋化因子受体的高表达,而更容易迁移至淋巴结,进而引起机体对抗肿瘤的免疫反应。
因此,TNF-α/IL-1β /IL-6/PGE2 组合广泛应用于临床,并被认为是制备成熟DC 的“金标准”。
07
各细胞因子使用浓度
请根据具体实验目的、细胞类型和培养条件进行优化,以确定适合自己实验需求的最佳浓度,表1中浓度仅供参考。
表1. 各细胞因子工作浓度
|
组分 |
工作浓度 |
|
Human GM-CSF |
500-1000 U/mL (50-100 ng/mL) |
|
Human IL-4 |
250-500 U/mL (50-100 ng/mL) |
|
Human TNF-α |
10 ng/mL |
|
Human IL-1β |
10 ng/mL |
|
Human IL-6 |
10-100 ng/mL |
|
PGE2 |
1 μg/mL |
6
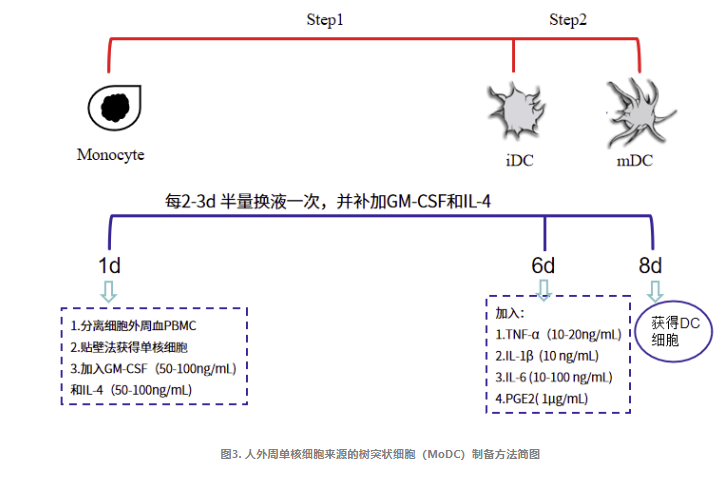
人外周血单核细胞来源树突状细胞(MoDC)的制备
01
外周血单核细胞的采集
1.1 用血细胞分离机采集患者自身的外周血单个核细胞 80-100mL;
1.2 淋巴细胞分离液密度梯度离心法进一步纯化单个核细胞(PBMC)。
1.3 无血清培养液洗涤2次,获得纯度在90%以上的 PBMC,细胞数量需达到(1-3)×108。
02
DC前体细胞培养
2.1 PBMC用完全培养基悬浮细胞,并调整细胞浓度至3×106/mL,并接种于培养板中;
2.2 37℃,5% CO2 培养箱中孵育2h,吸弃培养上清,用培养基轻轻洗培养板以去除非贴壁细胞,即获得贴壁的单核细胞;
2.3 在贴壁细胞中加入含重组人GM-CSF(500-1,000U/mL)和重组人 IL-4(500U/mL)的完全培养基,37℃,5% CO2 培养箱中培养,诱导单核细胞向DC细胞分化;
2.4 每 2-3d 半量换液一次,并补足人 GM-CSF和IL-4;
2.5 在培养的第 6d,加入重组人 TNF-α(10-20 ng/mL),IL-1β(10ng/mL),IL-6(1000U/mL)和PGE2(1μg/mL),诱导DC细胞成熟;
2.6 在培养的第 7d 或第 8d,收获 DC 细胞,其数量应达到 1×106 个以上;
03
DC 的质检
在培养过程中可进行细胞形态学观察和细胞活力检测。
3.1 活细胞比例:
台盼蓝染色验证活细胞应在 90%以上;
3.2 形态学观察:
>90%细胞半悬浮,细胞有多个树突样突起;
3.3 细胞表型分析:
流式细胞术检测 DC特异性表面标志物, CD14、HLA-DR、HLA-ABC、CD40、CD80、CD83 和 CD86 等分子的表达,成熟的DC不表达 CD14,而高表达其他分子。CD83 是成熟 DC 的特异性标志,在单核细胞和不成熟DC 表面不表达或低表达。
3.4 无菌检测:
收获细胞前取少量培养物进行细菌、真菌培养,并检测支原体、衣原体,均应为阴性;
3.5 内毒素检测:
收获细胞前取少量培养物,回输前,用鲎试剂检测内毒素含量,标准:内毒素<0.5 EU/ml。
3.6 抗原吸收能力检测:
使用dextran(葡聚糖)作为抗原,可以评估MoDC细胞的抗原吸收能力。收集单核细胞,不成熟DC和成熟DC,分别按1×105 cells/mL悬于完全培养基,再加入FITC-dextran(1 mg/mL),在37°C下,孵育0、5、10、20、30和60分钟。所有样品在冰上保持60分钟。60分钟后,使用含有1%胎牛血清的冰PBS洗涤所有样品两次(以300×g离心,5分钟,4°C),最后悬浮于含有0.5%BSA的PBS中。样品保持在冰上直到流式细胞术分析。通过流式细胞术测量FITC的平均荧光强度(MFI)来测定FITC-dextran的摄取。
3.7 成熟MoDC的迁移能力
Transwell实验:将mMo DC重悬于含有10%FCS的完全培养基中,密度5×105细胞/mL,取200µL在Transwell板的上部隔间中。下部隔室加满600µL含有重组人CCL19的完全培养基,重组人CCL19配制梯度浓度,检测不同浓度下 MoDC的迁移能力。3小时后,收获下隔室中包含的细胞,并计数。
3.8 MoDC诱导混合淋巴细胞增殖反应(MLR)
iDC在摄入抗原后,逐渐成熟并迁移到T淋巴细胞区域,递呈抗原刺激T细胞增殖引发免疫反应。 准备5×10⁶ CD4+T细胞悬浮在400µL PBS中,并用荧光染料标记T细胞。随后,细胞清洗3次。最后,将CD4+T细胞悬浮在MLR中,密度为5×10⁵ cells/mL。
悬浮单核细胞、imMo-DCs和mMo-DCs于MLR中,在密度为1×10⁶ cells/mL,并根据表2连续稀释。将不同的细胞稀释液(每孔100µL)置于96孔板中。随后,加入标记的T细胞(每孔100µL),并在37℃、5% CO2下培养7天。CD4+T细胞的增殖通过测量流式细胞术检测。
表2. Mo-DC/monocyte 连续稀释
|
Mo-DC/monocyte density (cells/mL) |
Number of Mo-DCs/monocytes per well |
Ratio of Mo-DCs/monocytes to T cells |
|
2.5×105 |
25000 |
1:2 |
|
1.25×105 |
12500 |
1:4 |
|
6.25×104 |
6250 |
1:8 |
|
3.13×104 |
3125 |
1:16 |
|
1.56×104 |
1562 |
1:32 |
|
7.81×103 |
781 |
1:64 |
7
DC培养试剂推荐
|
产品名称 |
货号 |
规格 |
价格(元) |
促销价(元) |
|
91102ES |
5μg/50μg/100μg/500μg |
535/3215/5145/14405 |
268/1608/2573/7203 |
|
|
91108ES |
5μg/50μg/100μg/500μg |
535/3265/4985/13465 |
268/1633/2493/6733 |
|
|
90105ES |
5μg/50μg/100μg/500μg |
535/3215/5145/12865 |
268/1608/2573/6433 |
|
|
90144ES |
5μg/50μg/100μg/500μg |
535/3215/5144/14405 |
268/1608/2572/7203 |
|
|
90601ES |
10μg/100μg/500μg |
815/2985/9985 |
408/1493/4993 |
|
|
90621ES |
5μg/20μg/50μg/500μg |
535/1605/3695/5545 |
268/803/1848/2273 |
|
|
90101ES |
2μg/10μg/50μg/100μg |
535/1855/5565/8905 |
268/928/2783/4453 |
|
|
90140ES |
2μg/10μg/50μg/100μg |
535/1855/3855/5785 |
268/928/1928/2893 |
|
|
90107ES |
5μg/20μg/50μg/100μg |
585/1755/3165/4755 |
293/878/1583/2378 |
|
|
90146ES |
2μg/10μg/50μg/100μg |
535/1855/3855/5395 |
268/928/1928/2698 |
|
|
60810ES03 |
1 mg |
545 |
436 |
8
产品特点
翌圣生物提供一系列与树突状细胞培养相关的HiActive®高活性细胞因子产品,以支持DC研究。
HiActive®高活性细胞因子: 每个细胞因子生物活性均经过验证,保证细胞因子的高活性。
活性验证:
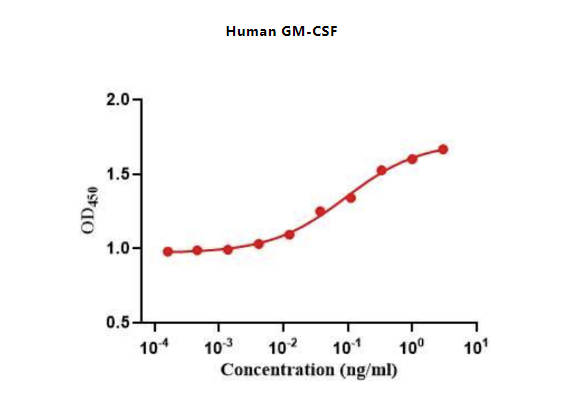
Figure 4. The ED50 as determined by a cell proliferation assay using human TF-1 cells is less than 0.1 ng/mL, corresponding to a specific activity of > 1.0 × 107IU/mg.
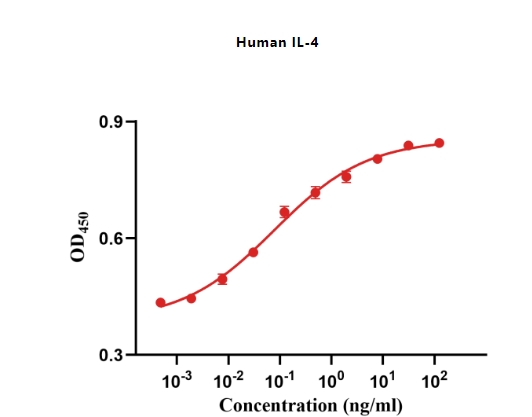
Figure 5. The ED50 as determined by a cell proliferation assay using human TF-1 cells is less than 0.1 ng/mL,corresponding to a specific activity of >1 × 107 IU/mg.
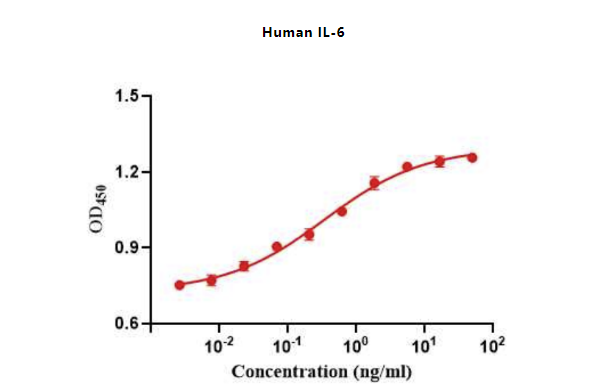
Figure 6. The ED50 as determined by a cell proliferation assay using human TF-1 cells is 0.23-0.48 ng/mL, corresponding to a specific activity of > 2.0 × 106IU/mg.
相关文献:
1.Anna C. Filley1 and Mahua Dey. Dendritic cell based vaccination strategy: an evolving paradigm.J Neurooncol. 2017 Jun; 133(2): 223–235.
2.Emma Verheye,et. al. Dendritic Cell-Based Immunotherapy in Multiple Myeloma: Challenges, Opportunities, and Future Directions.International. Journal of Molecular. Sciences. 2022, 23(2), 904;
