蛋白质与RNA的相互作用是许多细胞功能的核心,如蛋白质合成、mRNA组装、病毒复制、细胞发育调控等。蛋白-核酸互作是机制研究的重要组成部分,是表现、功能等研究的进一步深化。今天小编以一篇经典文献带你了解蛋白-核酸互作研究方法。
题目:Role of MYC-Regulated Long Noncoding RNAs in Cell Cycle Regulation and Tumorigenesis
期刊:Journal of the National Cancer Institute (JNCI)
影响因子:12.589
研究背景
哺乳动物基因组编码大量的非编码RNA,如microRNAs、piRNAs和lncRNAs。迄今为止,已经注释或鉴定了3万多个lncRNAs。目前已经在几种癌症中鉴定到lncRNAs,在结直肠癌(CRC)中也有一些报道,如CCAT1和CCAT2,但大部分lncRNAs 在CRC中的作用仍然鲜为人知,有待阐明。已知转录因子MYC调节lncRNAs并且与癌细胞增殖和肿瘤发生相关。本文作者利用荧光素酶启动子测定,ChIP,RNA pull-down,缺失图谱测定,LC-MS / MS和RIP等方法手段来探索MYC调控lncRNAs的相关机制。
研究内容及结果
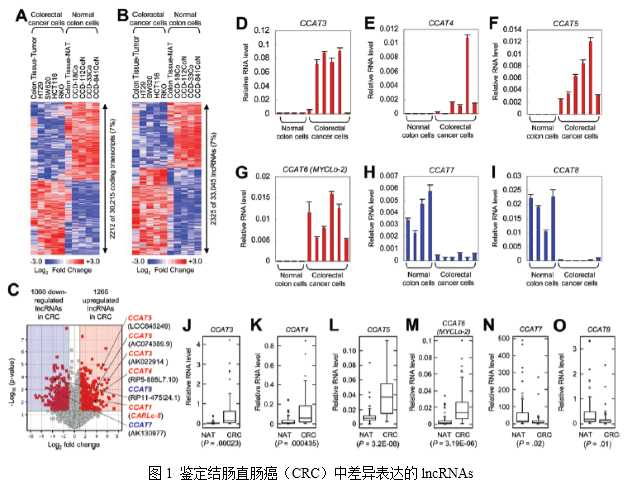
1. 鉴定结直肠癌(CRC)中特异表达的lncRNAs
作者利用lncRNAs基因芯片来分析正常结肠来源和CRC来源的细胞和组织中的lncRNAs。结果获得30215个蛋白质编码转录本和33045个有注释或已知的lncRNAs。其中在CRC中具有表达差异的蛋白质编码转录本(2212/30215)和lncRNAs(2325/33045)具有相似的比例,均为7%(图1,A和B)。
在2325个差异表达的lncRNAs中,有1265个上调和1060下调(图1C)。作者选取差异倍数大于15倍,P <0.01的差异表达的lncRNAs进行RACE快速扩增, 然后利用qRT-PCR进行验证。结果有4个lncRNAs(CCAT3、CCAT4、CCAT5和CCAT6)在CRC细胞系中上调表达(图1, D-G),CCAT7和CCAT8在CRC细胞系中下调表达(图1,H-I)。利用52个CRC组织和它们临近的正常组织(NATs)进行验证也证实了上述结果(图J-O)。
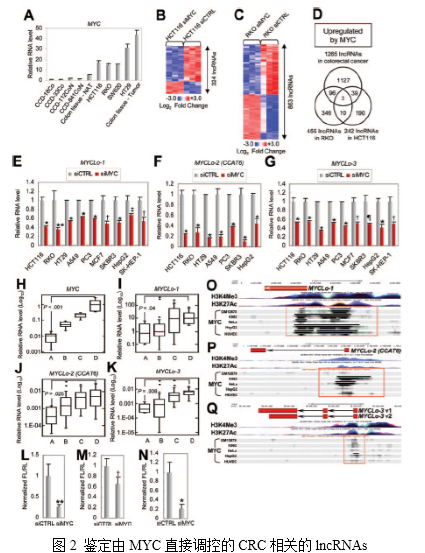
2. 进一步鉴定原癌基因MYC调控的CRC相关lncRNAs
为进一步鉴定由MYC调控的CRC相关lncRNAs的差异表达,作者利用lncRNAs微阵列筛选siMYC处理的CRC派生细胞系中的lncRNAs。结果,在HCT116细胞系和RKO细胞系中分别鉴定到324、863个由MYC调节的lncRNAs(图2B,C)。通过进一步筛选获得MYC上调的三种lncRNAs(AK021907,AC074389.9和KTN1-AS1)(图2D)。这些由MYC调控的lncRNAs被命名为MYCLos(MYCLos-1,MYCLos-2,MYCLos-3)。
接下来作者研究了由MYC介导调控的MYCLos在各种癌细胞中是否常见。结果表明,在各种癌症类型的细胞中都能观察到MYC介导调控MYCLos,表明MYC介导调控MYCLos在多种类型的癌症中是保守的(图2E-G)。
为了进一步验证MYC与MYCLos之间的关系,作者还研究了50个人类原发性结直肠癌组织样本(25个正常结肠和25个CRC组织样本)的表达水平,根据MYC表达水平分为4个组(图2H)。通过比较四组中MYCLo-1,-2和-3的表达水平,发现MYCLo-1,-2和-3的表达水平与MYC的表达水平在统计学上显著相关(图2,I-K)。此外,MYCLos在含有MYC过表达的CRC细胞系(图1G)中高度表达(图2A)。为测试MYC是否在转录水平调节MYCLo-1,-2和-3,作者利用荧光素酶报道分子对其进行了测定。结果表明,MYC基因抑制后,MYCLos启动子的活性降低,表明MYC在转录水平上诱导MYCLos表达(图2,L-N)。这些结果表明MYC诱导的MYCLos在转录水平上由转录增强子MYC直接调节。
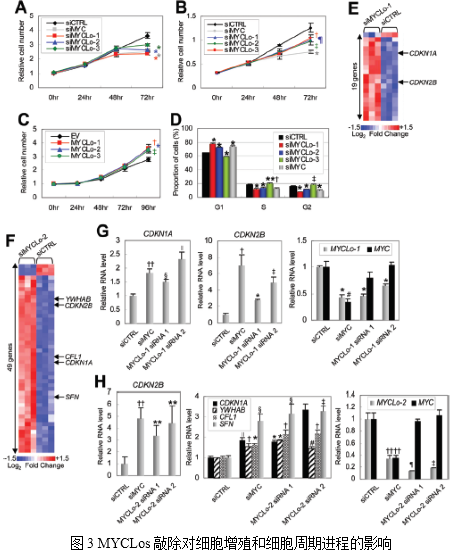
3. MYC诱导的MYCLos对CDKN1A、CDKN2B等MYC靶基因细胞增殖和表达的影响
原癌基因MYC通过调节许多细胞周期调节基因来促进细胞的增殖。作者将MYCLo-1,-2或-3以及MYC进行敲除,结果细胞增殖减少(图3A,3B)。敲除MYCLo-1或-2导致细胞在G1期积累,表明MYCLo-1和-2参与G1 / S转换(图3D)。敲除MYCLo-3导致S和G2期细胞积累,表明MYCLo-3在G2期具有调节功能(图3D)。另外作者还鉴定到有190、49和13个细胞周期调节基因分别由MYCLo-1、MYCLo-2和MYCLo-3调控(图3E-F)。
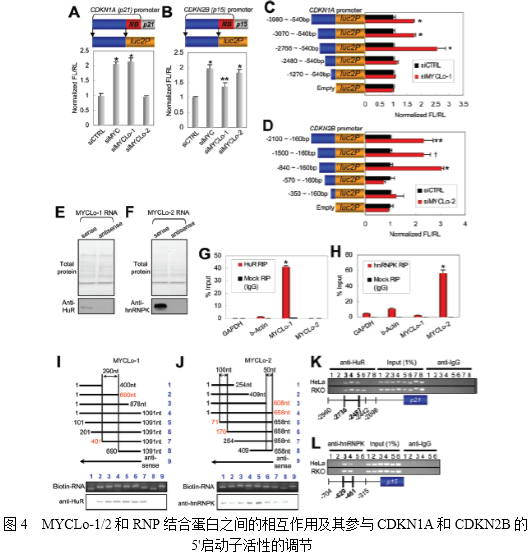
4. MYCLos介导的CDKN1A和CDKN2B在远端启动子区域的转录调节
为阐明MYC调控的lncRNAs抑制CDKN1A和CDKN2B表达的机制,作者分别在CDKN1A和CDKN2B基因的启动子中扩增了两个不同的区域,一个包括近端MYC结合(MB)区域,另一个包括没有MB区域的上游区域。然后利用荧光素酶实验对扩增的区域进行启动子测试(图4A和B)。MYC的敲除能诱导无MB区域的上游区域的启动子活性,敲除MYCLo-1或 -2也能诱导激活CDKN1A 和 CDKN2B的启动子活性(图4A,B)。表明MYC不仅在近端区域而且在其启动子的远端区域也可以调控CDKN1A和CDKN2B的转录活性。进一步见鉴定结果表明CDKN1A启动子区域大约在2768bp和2480bp之间对MYCLo-1调节CDKN1A起关键的作用(图4C),CDKN2B启动子区域大约在840bp和570bp之间对MYCLo-2调节CDKN2B起关键作用(图4D)。
5. MYCLos和RNA结合蛋白(如HuR和hnRNPK)的相互作用
为研究MYCLos的功能机制,作者使用RNA pull-down实验及质谱分析的方式鉴定RNA-相关的总蛋白(图4E,F)。结果发现10个与MYCLo-1相关的蛋白和8个与MYCLo-2相关的蛋白。通过使用RPISeq软件进行预测,作者还发现HuR-MYCLo-1、hnRNPK-MYCLo-2具有极大相互作用的可能性(图4G,H)。并且通过Western blot验证其相互作用(图4E,F)。
为进一步确认HuR-MYCLo-1、hnRNPK-MYCLo-2之间的相互作用,作者利用RIP实验进行了验证。结果与RNA pull-down实验结果一致,使用HuR抗体的RIP样品中MYCLo-1获得了富集(图4G),使用hnRNPK抗体的RIP样品中MYCLo-2也获得了富集(图4H)。这些结果表明HuR与MYCLo1的交互作用与CDKN1A的转录抑制有关,MYCLo-2通过与hnRNPK相互作用抑制CDKN2B的转录。
6. MYCLo-2的致癌功能
作者利用Northern blot验证了CRC细胞系中MYCLo-2(CCAT6)的过表达。发现大多数CRC组织中MYCLo-2具有非常高的表达水平,在52组相比较的组织样品中有46个CRC组织的MYCLo-2高度表达(图5A)。此外,与正常前列腺来源的细胞相比,MYCLo-2也在前列腺癌(PC)细胞和组织中过表达(图5B, C)。在体外集落形成测定中,敲除MYCLo-2能显着减少细胞和集落的数量,表明MYCLo-2在肿瘤细胞转化中具有作用(图5D)。
另外作者还通过使用MYCLo-2 siRNAs转染肿瘤细胞的体内异种移植,研究了MYCLo-2在肿瘤发生中的抑制作用。结果表明,MYCLo-2损耗对肿瘤的发展有明显的抑制作用(图5E)。上述结果表明,MYCLo-2不仅在肿瘤中过表达,还参与肿瘤发生和肿瘤生长。
文章小结
该文章使用多种技术研究MYC调控lncRNAs的相关机制,揭示了MYCLos通过调节已知的MYC靶基因的表达来参与细胞增殖和细胞周期的调控,另外还发现MYCLo-1与HuR和MYCLo-2与hnRNPK之间的相互作用。进一步研究表明这些相互作用可能参与对MYC靶标(如CDKN1A和CDKN2B)的调控。此外,将MYCLo-2进行敲除能够抑制癌细胞转化和肿瘤发生。这些研究成果对于发现新的癌症靶标和研究MYC相关的发病机制具有重要意义。
小编告诉您,文中涉及到的RNA pull-down , LC-MS/MS, ChIP, RIP技术,金开瑞都可以妥妥的帮您完成哦!
如何低成本研究空间转录组?看完这篇文章你或许会有答案
(2022-06-02T14:51 浏览数:8335)
【周二晚八点】从位置到功能--空间转录组应用
(2022-05-16T08:59 浏览数:9064)
Cell Reports:利用空间转录组解析哺乳动物精子生成
(2022-04-28T14:54 浏览数:10731)
RNA二级结构调控基因表达的研究现状和进展
(2022-04-21T13:39 浏览数:8190)
Nature: MERFISH绘制小鼠初级运动皮层空间细胞图谱
(2022-04-18T13:24 浏览数:7268)
大自然的恩赐-外泌体药载
(2022-04-08T13:43 浏览数:8394)
【详解】基于图像的单细胞空间分辨转录组学技术
(2022-04-01T11:18 浏览数:12400)
知无不“研”,五分钟带你了解空间分辨转录组学的前世今生
(2022-03-18T14:00 浏览数:9173)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:7592)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:8013)