
影响因子:19.568
发表时间:2023年2月4日
研究方法:m5C MeRIP-seq、m5C Bis-seq、RNA-seq、LC-MS/MS
文章链接:NSUN2-mediated M5c methylation of IRF3 mRNA negatively regulates type I interferon responses during various viral infections
提供服务:

1、NSUN2负调控I型干扰素反应
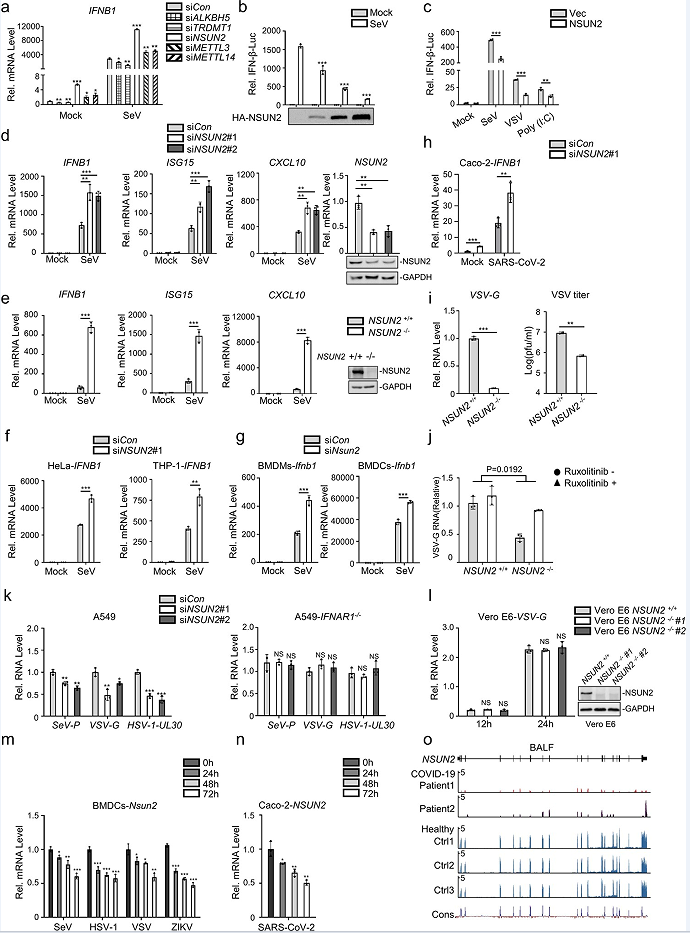
为了探索参与I型干扰素反应的RNA甲基转移酶或去甲基化酶的功能,文章使用小干扰RNA(siRNAs)敲除HEK293T细胞中不同的RNA甲基转移酶或去甲基化酶,并检测内源性IFNB1 mRNA水平。qPCR结果发现,NSUN2的敲除可以更显著地提高内源性IFNB1 mRNA水平(图1a)。为了证实NSUN2对I型干扰素反应的影响,文章检测了外源性NSUN2的表达,发现它可以以剂量依赖性的方式抑制仙台病毒(SeV)诱导的IFN-β启动子活性的激活(图1b)。外源性NSUN2的表达也可以抑制不同刺激物诱导的IFN-β启动子活性的激活(图1c)。在NSUN2敲低的HEK293T细胞中,SeV诱导的内源性IFNB1 mRNA水平的增加显著增加,下游的ISG15和CXCL10的mRNA水平也显著增加(图1d)。SeV诱导的I型干扰素反应在NSUN2敲除的HEK293T细胞中也显著增强(图1e)。此外,NSUN2的敲除也促进了SeV诱导的I型干扰素对HeLa、THP-1、骨髓来源树突状细胞(BMDCs)和骨髓来源巨噬细胞(BMDMs)的I型干扰素反应(图1f,g)。在SARS-CoV-2感染的Caco-2细胞中,敲除NSUN2持续促进了I型干扰素应答,这表明NSUN2在SARS-CoV-2感染中也发挥了重要的调控作用(图1h)。
接下来,文章继续研究了NSUN2是否参与了水疱性口炎病毒(VSV)感染期间的抗病毒应答。在HEK293T中敲除NSUN2显著抑制了携带绿色荧光蛋白(GFP)报告基因(VSV-GFP)的VSV的复制(图1i),鲁索利替尼可以增强VSV对NSUN2敲除细胞中增殖的抑制作用(图1j)。此外,敲除NSUN2抑制了SeV、VSV和单纯疱疹病毒1(HSV-1)在A549野生型细胞中的增殖,但在A549IFNAR1−/−细胞中没有增殖(图1k)。为了进一步研究NSUN2在病毒感染过程中的生物学作用,文章观察到在SeV或寨卡病毒(ZIKV)感染后,NSUN2 mRNA随着时间的推移而减少,这揭示了NSUN2在病毒感染过程中的潜在功能(图1m)。值得注意的是,文章发现SARS-CoV-2感染也可以显著降低Caco-2细胞中的NSUN2 mRNA水平(图1n)。因此,文章进一步对从2例covid-19患者的支气管肺泡灌洗液(BALF)中分离的RNA进行了RNA-seq。结果发现与健康人相比,COVID-19患者的NSUN2 mRNA水平持续降低(图1o)。综上所述,NSUN2可能作为I型干扰素应答的负调控因子,在包括SARSCoV-2在内的不同病毒感染期间,NSUN2的表达显著降低,以增强抗病毒I型干扰素应答。
2、NSUN2通过调节IRF3的表达水平来抑制I型干扰素反应
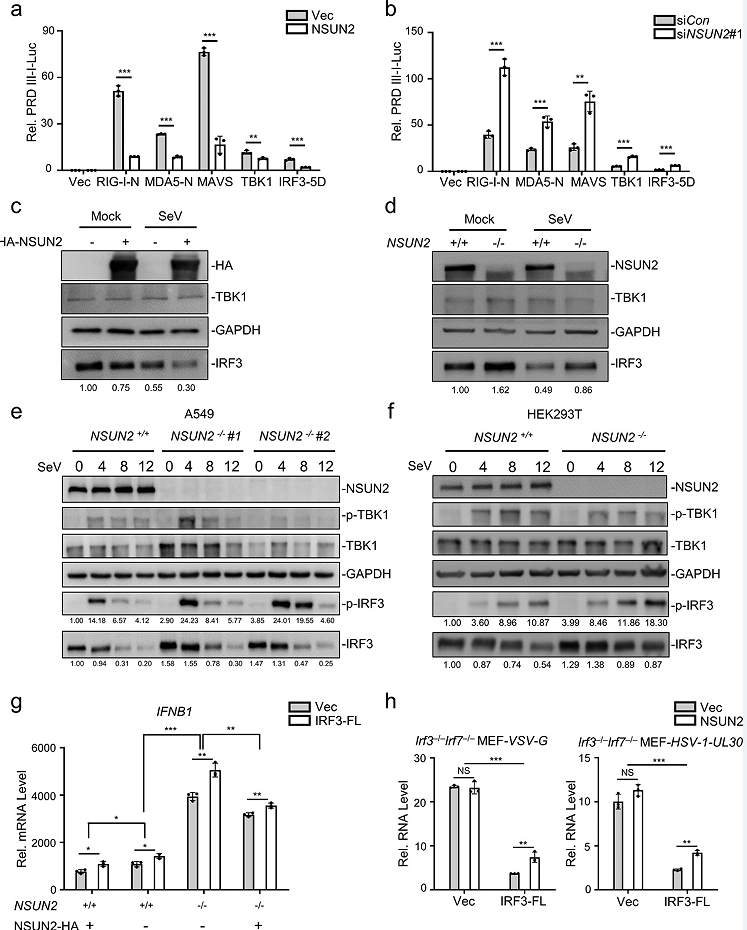
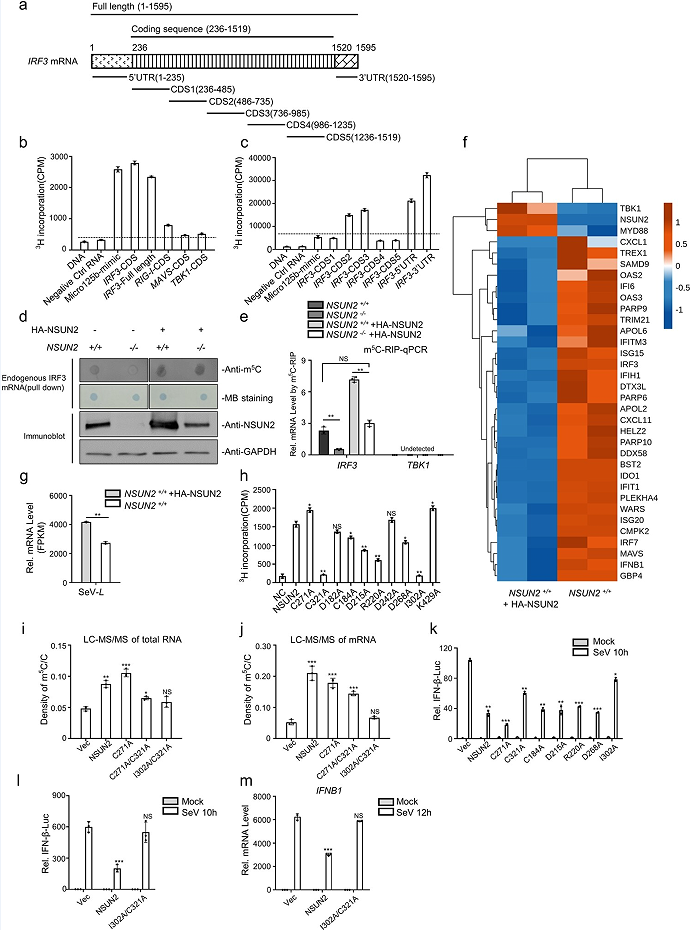
文章发现外源性NSUN2的表达显著抑制了上游激活物诱导的PRDIIII-luc活性(图2a),而抑制NSUN2有相反的效果(图2b)。由于IRF3是I型干扰素应答启动过程中的最终因素,文章推测NSUN2可能在IRF3节点上发挥其功能。免疫印迹分析显示,外源性NSUN2表达可以抑制内源性IRF3水平增强(2c),相比之下,内源性TBK1蛋白水平没有明显变化。此外,敲除NSUN2促进了IRF3 Ser396的磷酸化水平,对TBK1 Ser172的磷酸化水平则无促进效果(图2e,f)。这些结果表明,NSUN2的缺失可以提高IRF3蛋白的整体水平及其磷酸化水平。qPCR分析结果显示IRF3是NSUN2调控干扰素反应的主要下游靶点(图2g)。因此,文章进一步使用IRF3−/−Irf7−/−mef,将NSUN2和IRF3-FL与VSV或HSV-1感染共转染,发现NSUN2对病毒繁殖的促进依赖于IRF3的存在(图2h)。综上所述,这些结果表明,NSUN2可以特异性抑制IRF3的表达,从而负调控病毒感染后的I型干扰素应答。
3、NSUN2催化IRF3 mRNA的m5 C甲基化
文章推测NSUN2可能与IRF3 mRNA发生物理上的相互作用。CO-IP和WB结果显示,在HEK293T中,NSUN2和IRF3蛋白之间没有相互作用(图3a)。文章进一步在SeV刺激的HEK293T细胞中过表达并免疫沉淀NSUN2蛋白,并对其进行RNA提取和qPCR。结果显示,NSUN2确实与内源性IRF3 mRNA结合,而内源性TBK1 mRNA不与NSUN2相互作用(图3b),敲除NSUN2提高了内源性IRF3 mRNA水平,而内源性TBK1 mRNA水平没有受到影响(图3c,d)。随后,文章检测了野生型和NSUN2mRNA2−/−HEK293T细胞内源性IRF3 mRNA的半衰期,结果发现,敲除NSUN2显著提高了IRF3 mRNA的半衰期(图3e)。此外,文章使用HA-tag抗体从NSUN2-/- HEK293T中沉淀HA-NSUN2蛋白,并重组外源性HANSUN2(图3f)。综上结果表明,NSUN2主要通过与IRF3 mRNA结合并加速其降解来降低IRF3蛋白水平。
使用重组GST-NSUN2和3h标记的S-腺苷蛋氨酸(SAM)对这些RNA进行体外甲基化分析。与RIG-I、MAVS和TBK1的转录本相比,转录后的IRF3 mRNA可被NSUN2高度甲基化(图4a,b)。这些数据表明,与RIG-I、MAVS和TBK1 mRNA相比,NSUN2可以在体外有效地介导IRF3 mRNA的甲基化。为了确定哪个区域可能被甲基化,文章将IRF3 mRNA分为7个部分(图4a),与其他片段相比,IRF3 5‘UTR、3’UTR、CDS2和CDS3被NSUN2高度甲基化(图4c)。将等量的内源性IRF3 mRNA装载在细胞膜上,并测定m5 C的水平。m5C merip-seq结果显示,NSUN2敲除细胞中IRF3 mRNA的m5 C甲基化水平明显低于野生型细胞(图4d)。m5C meRIP-qPCR的结果显示,NSUN2敲除细胞中内源性m5 C甲基化的IRF3 mRNA水平明显低于野生型细胞,而外源性NSUN2的表达可显著提高内源性m5 C-甲基化的IRF3 mRNA水平(图4e)。随后,文章进一步通过RNA-seq数据分析了过表达NSUN2的HEK293T细胞或HEK293T细胞中mRNA的表达水平。从这些结果来看,在NSUN2过表达的细胞中,IRF3、IFNB1及其下游的ISGs持续下调(图4f),而相应的SeV复制增强(图4g)。然而,上游信号因子如RIG-I(DDX58)、TBK1或MAVS并没有表现出NSUN2的一致或显著调控。这些结果显示,NSUN2介导的IRF3 mRNA的m5 C甲基化调控了IRF3 mRNA水平和IRF3介导的IFNB1和下游ISGs水平(图4d,e)。甲基转移酶突变体C271A能提高NSUN2的催化活性(图4h)。文章利用LC-MS/MS检测了转染了NSUN2或其突变体的NSUN2−/−HEK293T细胞中总RNA(图4i)或mRNA(图4j)的m5 C甲基化水平。如图4(k)所示,与野生型NSUN2相比,I302A或C321A过表达后,SeV诱导-IFN-β荧光素酶检测中部分抑制能力丧失,而C271A与野生型NSUN2相比可增强抑制能力。此外,在NSUN2−/−HEK293T细胞中,双突变体I302A/C321A在功能(图4l)和对IFNB1 mRNA水平的影响(图4m)方面都完全失去了其抑制能力。
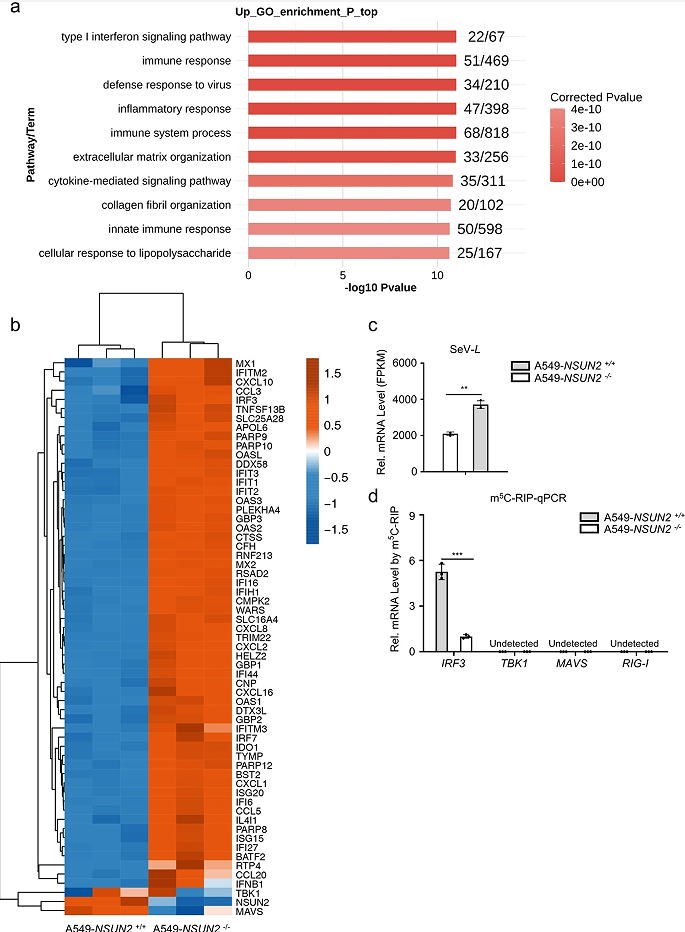
RNA-seq的GO分析结果表明敲除NSUN2有助于免疫应答的显著升高,这进一步证明了NSUN2在抗病毒先天免疫应答中的关键作用(图5a)。在A549 NSUN2敲除细胞中,IRF3、IFNB1及其下游ISGs持续上调,而相应的SeV复制受到抑制(图5b,c)。同时,A549 NSUN2敲除细胞中内源性m5 C甲基化IRF3 mRNA水平显著低于A549野生型细胞(图5d)。
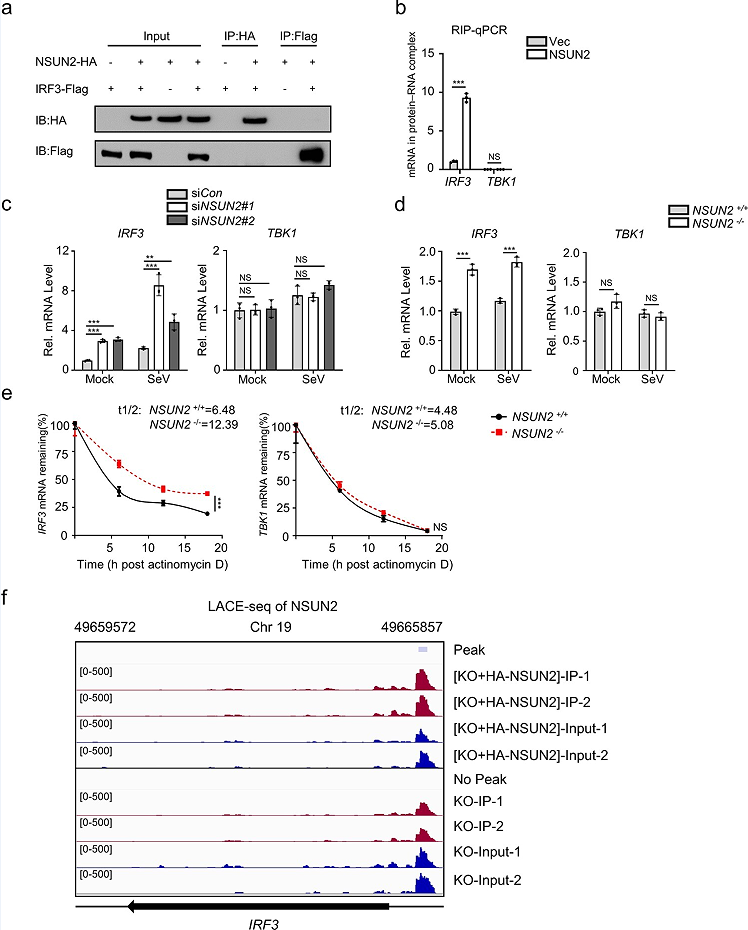
图3.NSUN2与IRF3 mRNA相互作用并诱导其降解
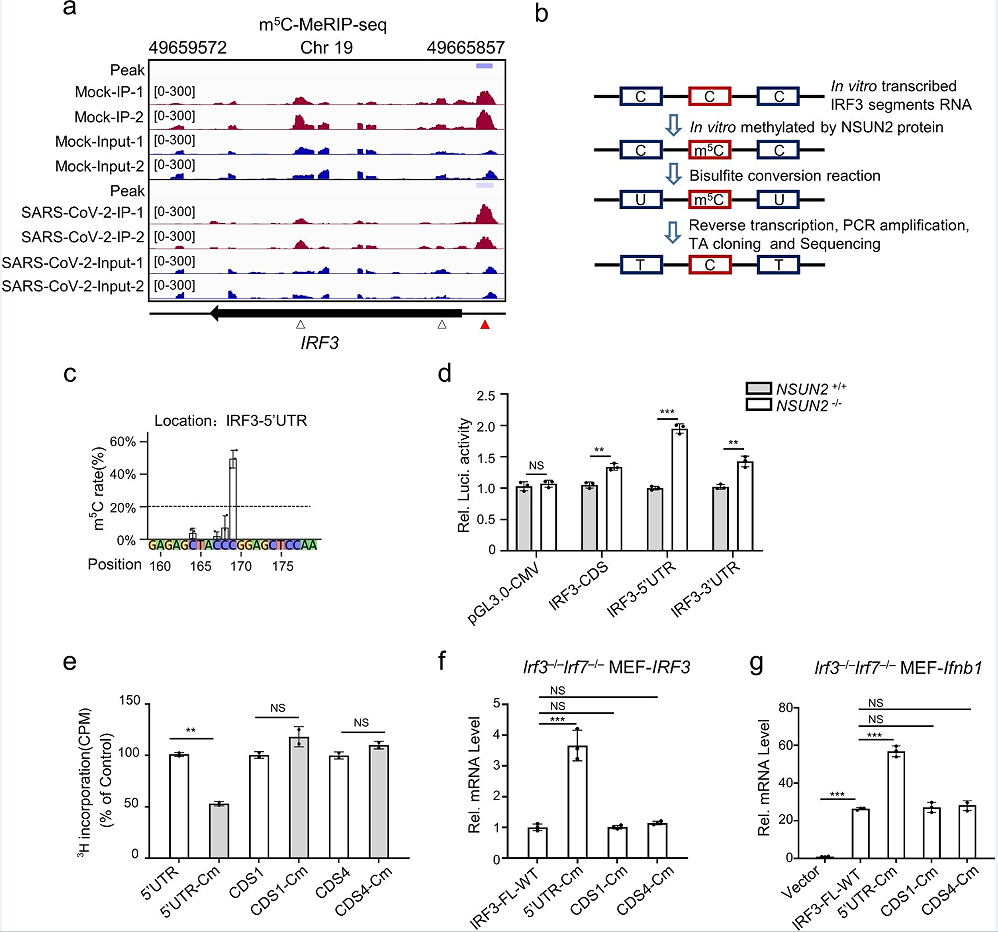
4、IRF3 mRNA的甲基化胞嘧啶调节RNA水平
m5C MeRIP-seq转录组分析发现了未感染或sars-cov-2感染的Caco-2细胞中RNA的内源性m5C位点(图6a)。m5C Bis-seq分析发现(图6b),IRF3 mRNA中的一个甲基化胞嘧啶是甲基化的主要位点,在体外被重组NSUN2蛋白高度甲基化:5‘UTR中的C169(图6c)。此外,还发现了另外三个高度甲基化的胞嘧啶:3‘UTR中的C1569,CDS2中的C556(486-735),CDS3中的C815(736-985),与在IRF3 mRNA中观察到的四个高甲基化区域一致(图4c )。进一步研究NSUN2对IRF3 mRNA的m5 C甲基化的生物学功能,如图6(d)所示,敲除NSUN2可以增加报告基因pGL3-IRF3-5‘UTR、pGL3-IRF3-CDS和pGL3- IRF3-3’UTR的荧光素酶活性。在5‘UTR中观察到突变C169(C到G),在3‘UTR中观察到突变C1569(C到G),CDS2(486-735)的C556(C到T,同义突变)和CDS3(736-985)的C815(C到A,同义突变),这四个突变位点在重组NSUN2中的甲基化水平降低了一半。随后,文章构建了包含野生型IRF3全长(IRF3-fl,1-1595nt)或不同位点突变的IRF3- FLs的表达质粒。发现与野生型IRF3全长(IRF3-FL-WT)相比,这4个胞嘧啶的突变可以持续提高IRF3−/−Irf7−/−mef中IRF3 mRNA的表达水平(图6f)。位于CDS1(C303)或CDS4(C1135)中的另外两个胞嘧啶(图6a)在m5C Bis-seq中未被检测到,并且对其功能没有影响(图6f和g)。综上所述,研究结果表明,m5C修改的损失可能导致IRF3 mRNA的稳定性和增强IFN-β生产,从而促进更强的抗病毒反应,而IRF3 mRNA高度甲基化胞嘧啶在Nsun2介导的抗病毒反应发挥关键作用。
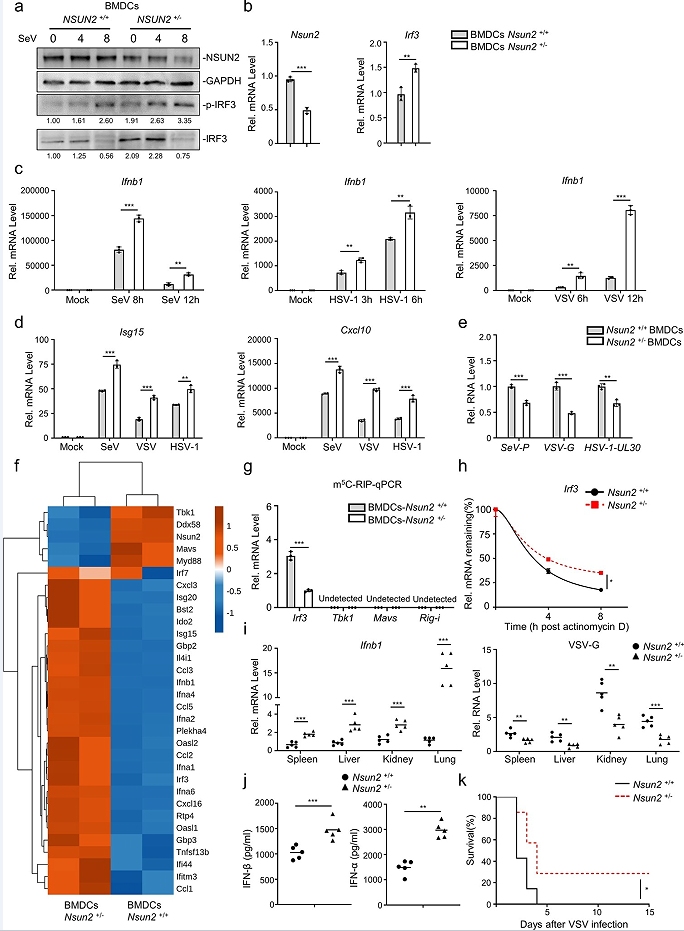
5、NSUN2在体内诱导I型干扰素和抗病毒应答中的关键作用
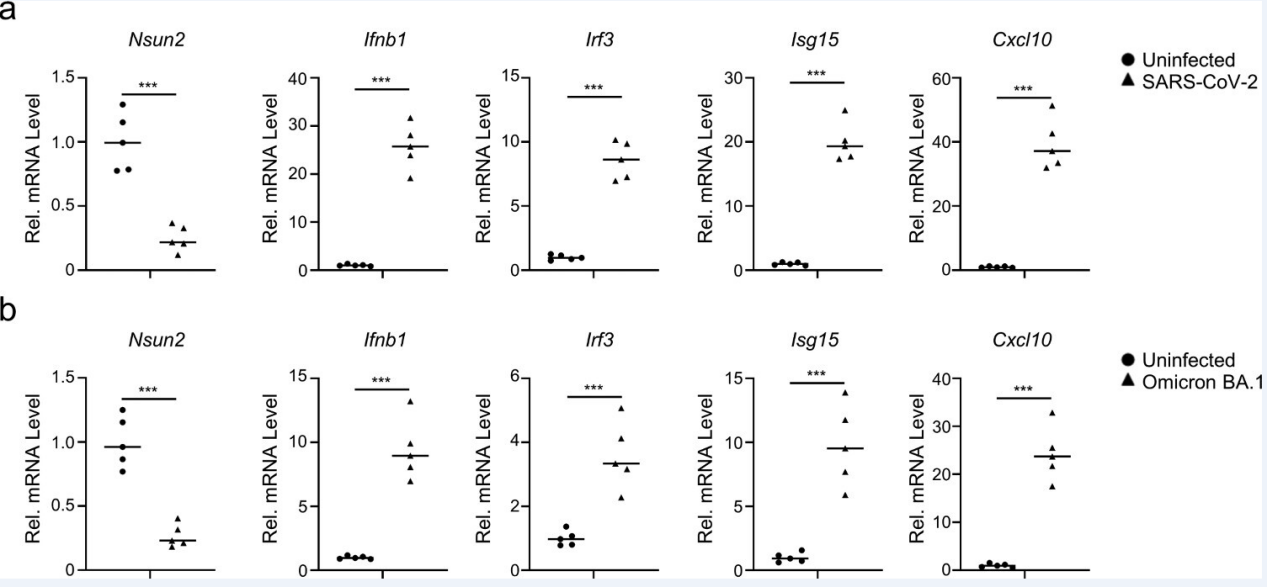
Nsun2+/−小鼠中Nsun2的表达比野生型同窝小鼠减少了一半(图7a,b),在感染SeV后,Nsun2+/−小鼠的BMDCs中内源性IRF3mRNA水平和蛋白水平均比野生型同窝小鼠中增强(图7a,b)。此外,如图7(c)所示,与使用SeV、HSV-1或VSV的野生型小鼠相比,Nsun2+/−小鼠的BMDCs中Ifnb1 mRNA水平显著提高了。IFN-β介导的下游Isg15和Cxcl10在Nsun2+/−小鼠的BMDCs中也显著增强(图7d)。因此,在Nsun2+/−小鼠的BMDCs中,SeV、HSV-1或VSV明显受到抑制(图7e)。来自Nsun2+/−小鼠或Nsun2+/+小鼠的BMDCs的RNA-seq结果表明,在Nsun2+/−小鼠的BMDCs中,Irf3、Ifnb1和下游ISGs持续升高(图7f)。同时,Nsun2+/−小鼠相比于Nsun2+/+小鼠,BMDCs中内源性m5 C甲基化的Irf3 mRNA水平更低(图7g)。然而,mRNA上Rig-i、Tbk1或Mavs没有显著的m5 C修饰信号。在Nsun2+/−小鼠的BMDCs中,内源性IRF3 mRNA的稳定性更高(图7h)。随后,文章研究了野生型小鼠和Nsun2+/−小鼠的先天抗病毒应答。结果发现,在mRNA水平上,相比于野生型小鼠,Nsun2+/−小鼠不同器官中的IFN-β产量更高,VSV的病毒负荷更低(图7i)。并且在ELISA腹腔注射VSV后,Nsun2+/−小鼠的血清中IFN-β和IFN-α的产生显著升高(图7j)。此外,文章还比较了腹腔注射VSV后的生存率。结果表明,野生型小鼠比Nsun2+/−小鼠更容易发生VSV触发的死亡(图7k)。
文章进一步研究了SARSCoV-2感染的K18-hACE2基因敲入(KI)小鼠模型的先天免疫应答和NSUN2的表达水平。研究发现SARS-CoV-2 WT菌株(图8a)或BA.1 omicron变异(图8b)激活了K18-hACE2 KI小鼠模型中的先天免疫反应。SARS-CoV-2 WT菌株或BA的内源性Nsun2 mRNA水平显著降低。与未感染组相比,有1个omicron变异感染组(图8a和b)。这些结果与SARS-CoV-2感染的Caco-2细胞模型和COVID-19患者相一致,共同表明NSUN2在SARS-CoV-2感染中起着重要的调控作用(图1n和o)。
本研究通过m5C MeRIP-seq、RNA-seq、m5C Bis-seq等多种技术的联合分析,发现在病毒感染过程中,内源性NSUN2的表达水平降低,因此IRF3 mRNA的m5 C修饰水平降低,但稳定性增加。因此,IRF3的表达水平提高,允许更强的干扰素反应和有效的消除病毒。这种重要的宿主抗病毒策略来调节干扰素反应的进化表明,NSUN2介导的m5 C修饰具有重要的生理意义。
m5C RNA甲基化测序(m5C-seq)
对m5C RNA甲基化,目前流行的检测手段为m5C-Seq技术,适用于m5C RNA甲基化谱研究,快速筛选m5C RNA甲基化靶基因。云序可提供mRNA和多种非编码RNA的m5C测序:
m5C 全转录组测序(涵盖mRNA,LncRNA,circRNA)
m5C LncRNA测序(涵盖LncRNA和mRNA)
m5C Pri-miRNA测序(涵盖Pri-miRNA和mRNA)
m5C mRNA测序
02 检测整体m5C RNA甲基化水平
LC-MS/MS检测整体RNA甲基化水平
精准高效,可以实现一次检测,9类修饰水平检测,一步到位。
03 m5CRNA甲基化上游酶的筛选
m5CRNA甲基化相关酶PCR芯片
寻找上游直接调控m5C RNA甲基化的甲基转移酶。
04 m5C RNA甲基化靶基因验证
meRIP-qPCR
云序提供各类不同修饰的meRIP-qPCR服务,可针对mRNA,lncRNA,环状RNA等不同类型的RNA分子进行检测,低通量验证RNA修饰靶基因表达水平。
05 机制互作研究
5.1 RIP-seq/qPCR
筛选或验证RNA修饰直接靶点,研究RNA修饰靶基因的调控机制。
5.2 RNA pull down -MS/WB
筛选或验证目标RNA互作基因或蛋白,研究相应的分子调控机制。
5.3 双荧光素酶实验
验证两基因互作,研究相应的分子调控机制。
5.4 ChIP-seq
筛选或验证目标蛋白与DNA互作,研究相应的分子调控机制。
优势二:累计完成数千例 RNA甲基化测序样本,覆盖医口、农口等各类样本。
优势三:可检测mRNA和各类非编码RNA(circRNA,lncRNA,Pri-miRNA等)。
优势四:提供m5C一站式服务:m5C整体水平检测、m5C-seq、MeRIP-qPCR验证、RIP和RNA pull-down等。
优势五:超微量MeRIP测序技术,RNA量低至500ng起。
优势六:提供多种 RNA 修饰测序服务,包含m6A、m6Am、m5C、m1A、m7G、m3C、O8G、ac4C乙酰化和2'-O-甲基化测序。
相关产品
上海云序生物科技有限公司 商家主页
地 址: 上海市松江区莘砖公路518号24号楼4楼
联系人: 戴小姐
电 话: 021-64878766
传 真: 021-64878766
Email:market@cloud-seq.com.cn;liuqingqing@cloud-seq.com.cn
